
| A. | 反应2NO2═N2O4在室温下可自发进行,则该反应的△H<0 | |
| B. | 工业上电解熔融态氯化铝冶炼单质铝 | |
| C. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH 减小 |
分析 A.反应自发进行的判断依据是△H-T△S<0;
B.氯化铝不导电;
C.加水稀释促进弱酸的电离;
D.Na2CO3溶液存在CO32-+H2O?HCO3-+OH-,溶液呈碱性,加入少量Ca(OH)2固体,发生CO32-+Ca2+=CaCO3↓,以此解答该题.
解答 解:A.2NO2═N2O4在室温下可自发进行,反应△S<0,△H-T△S>0,说明该反应的△H<0,故A正确;
B、氯化铝不导电,则不能利用电解熔融氯化铝冶炼金属铝,故B错误;
C.向CH3COOH溶液中加水,加水稀释促进醋酸的电离,醋酸根离子的物质的量增大,醋酸的物质的量减小,则溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值减小,故C错误;
D.Na2CO3溶液存在CO32-+H2O?HCO3-+OH-,溶液呈碱性,加入少量Ca(OH)2固体,发生CO32-+Ca2+=CaCO3↓,则c(OH-)增大,pH增大,c(CO32-)减小,水解程度减小,故D错误.
故选A.
点评 本题考查了自发进行的判断依据、电解冶炼金属铝、盐的水解、弱酸的电离等,题目难度中等,侧重于有关原理的考查.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
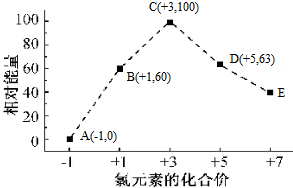
| A. | 所含氯元素的化合价越高,该物质的能量越高 | |
| B. | 所含氯元素的化合价越高,该物质越不稳定 | |
| C. | B→A+D的热化学方程式为3ClO-(aq)=2Cl-(aq)+ClO3-(aq)△H=-117kJ•mol-1 | |
| D. | ClO2-→ClO3-+ClO4-可以自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的系统命名:3,4-二甲基已烷
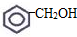
的系统命名:3,4-二甲基已烷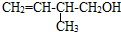 的键线式:
的键线式:
 ③
③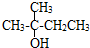 ④
④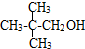 ⑤
⑤ ⑥
⑥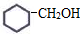
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀有气体的原子能形成分子晶体 | B. | 离子晶体中,一定存在离子键 | ||
| C. | 原子晶体中,只存在共价键 | D. | 金属晶体的熔沸点均很高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
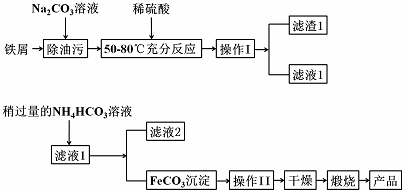
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+HCl═NH4Cl | B. | 8NH3+3Cl2═6NH4Cl+N2 | ||
| C. | 2NH3+2Na═2NaNH2+H2 | D. | 2NH3+3CuO═3Cu+N2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硫代替硫铁矿可以避免对环境的污染 | |
| B. | 接触室中的热交换器是为预热反应物和冷却生成物、节约能量而设计的 | |
| C. | 吸收塔中气体和浓H2SO4一起从塔顶端进入生成成品酸 | |
| D. | 用水吸收SO3使之成为硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com