
【题目】A、B、C、D 为原子序数依次增大的短周期主族元素,E 是一种过渡元素。A 基态原子 L 层中 p 轨道电子数是 s 轨道电子数的 2 倍,B 是同周期元素中最活泼的金属元素, C 和 A 形成的一种化合物是引起酸雨的主要大气污染物之一,E 的基态原子 4s 轨道半充满 和 3d 轨道全充满。请回答下列问题:
(1)B 基态原子的电子排布式是___________,C 和 D 中电负性较大的是______填元素符号)。
(2)C 的氢化物的沸点低于与其组成相似的 A 的氢化物,其原因是___________。
(3)C 与 A 形成的 CA3 分子的空间构型是___________。
(4)A 和 B 所形成的一种离子化合物 B2A 晶体的晶胞如图所示,则图中黑球代表的离子是_____(填离子符号)。

(5)在过量的氨水中,E 的阳离子与氨分子通过___________形成一种显深蓝色的离子, 该离子的符号为___________。
【答案】1s22s22p63s1 或[Ne]3s1 Cl H2S 分子间不存在氢键,H2O 分子间存在氢键 平面三角形 Na+ 配位键 [Cu(NH3)4]2+
【解析】
A基态原子L层中p轨道电子数是s轨道电子数的2倍,s轨道上有两个电子,则p轨道上有4个电子,所以A的核外电子数为8,是氧元素;B的序数比A大且是同周期元素中最活泼的金属元素,所以B为第三周期的钠元素; 因为C的序数比A大,所以C和A形成的引起酸雨的主要大气污染物之一的化合物是二氧化硫,则C是硫元素;D的序数比C大,且为主族元素,所以D是氯元素;E是一种过渡元素,E的基态原子4s轨道半充满和3d轨道全充满,则E的核外电子数是29,为铜元素。
(1)由分析可知,B是钠元素,基态原子的电子排布式是1s22s22p63s1 或[Ne]3s1,C为硫元素,D为氯元素,根据元素周期律,同一周期从左到右电负性逐渐增大,所以电负性较大的是Cl,故答案为:1s22s22p63s1 或[Ne]3s1;Cl;
(2)非金属元素氢化物的沸点与氢键有关,因为H2S分子间不存在氢键,H2O分子间存在氢键所以硫化氢的沸点低于与其组成相似的水的沸点,故答案为:H2S 分子间不存在氢键,H2O 分子间存在氢键;
(3)C与A形成的CA3分子SO3,SO3分子中有3个σ键,孤电子对数为![]() =0,则空间构型为平面三角形,故答案为:平面三角形;
=0,则空间构型为平面三角形,故答案为:平面三角形;
(4)白球占有顶点和面心,因此白球的个数为![]() ,黑球位于体心,有8个,因此个数比为1:2,此物质的分子式为Na2O,因此黑球是Na+,故答案为:Na+;
,黑球位于体心,有8个,因此个数比为1:2,此物质的分子式为Na2O,因此黑球是Na+,故答案为:Na+;
(5)在过量的氨水中,铜离子能提供空轨道,氨气分子中的氮原子提供孤电子对,形成配位键,所以铜离子与氨分子通过配位键能形成[Cu(NH3)4]2+,故答案为:配位键;[Cu(NH3)4]2+。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() CH=CH-CHO),杏仁含苯甲醛(
CH=CH-CHO),杏仁含苯甲醛(![]() CHO)。下列说法错误的是
CHO)。下列说法错误的是
A. 肉桂醛,苯甲醛都能发生加成反应、取代反应和聚合反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛和苯甲醛互为同系物
D. 苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,恒容密闭容器内发生反应:H2(g)+I2 (g) ![]() HI(g) Δ H< 0,该温度下, K=43。某时刻,测得容器内 H2、I2、HI 的浓度依次为 0.01 mol/L、0.01mol/L、0.02mol/L。 一段时间后,下列情况与事实相符的是
HI(g) Δ H< 0,该温度下, K=43。某时刻,测得容器内 H2、I2、HI 的浓度依次为 0.01 mol/L、0.01mol/L、0.02mol/L。 一段时间后,下列情况与事实相符的是
A.氢气的体积分数变小B.混合气体密度变大
C.混合气体颜色变深D.容器内压强变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓硫酸和乙醇混合加热制取乙烯,下列说法正确的个数是( )

①浓硫酸只作催化剂
②在反应容器中放入几片碎瓷片防止混合液暴沸
③反应温度缓慢上升至 170℃
④用排水法或向下排气法收集乙烯
⑤圆底烧瓶中装的是 4mL 乙醇和 12mL 3mol/L H2SO4混合液
⑥温度计应插入反应溶液液面下,以便控制温度
⑦反应完毕后先熄灭酒精灯,再从水中取出导管
⑧该反应类型属于取代反应
⑨若 a 口出来的气体使酸性 KMnO4溶液褪色,说明有乙烯生成
A.1B.2C.3D.4 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因新型冠状病毒肺炎疫情防控需求,口罩已经成为了2020每个人必备之品。熔喷布,俗称口罩的“心脏”,是口罩中间的过滤层,能过滤细菌,阻止病菌传播。熔喷布是一种以高熔融指数的聚丙烯(PP)为材料,由许多纵横交错的纤维以随机方向层叠而成的膜。其中有关聚丙烯的认识正确的是
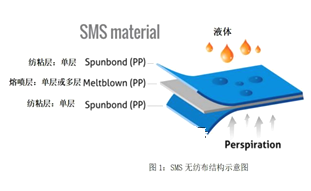
A.由丙烯通过加聚反应合成聚丙烯
B.聚丙烯的链节:—CH2—CH2—CH2—
C.合成聚丙烯单体丙烯的结构简式:CH2CHCH3
D.聚丙烯能使溴水发生加成反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生下列反应2A(g) + B(g) ![]() xC(g) + 2D(g),经4min后达平衡,测得D的浓度为1.0 mol·L-1,c(A) : c(B)=2 : 3,以C表示的平均速率υ(C)=0.125 mol·L-1·min-1,下列说法不正确的是
xC(g) + 2D(g),经4min后达平衡,测得D的浓度为1.0 mol·L-1,c(A) : c(B)=2 : 3,以C表示的平均速率υ(C)=0.125 mol·L-1·min-1,下列说法不正确的是
A. 反应速率υ(A)=0.25 mol·L-1·min-1
B. 该反应方程式中,x=1
C. 4 min时,B的物质的量为2 mol
D. 该反应的平衡常数K=1/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com