
A、△H=
| ||||
B、△H=
| ||||
C、△H=
| ||||
D、△H=
|
| 1 |
| 2 |
| 1 |
| 2 |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:

| A、X是正极,Y是负极 |
| B、X是负极,Y是正极 |
| C、CuSO4溶液的pH逐渐减小 |
| D、NaCl溶液的pH逐渐变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸和NaOH溶液反应,生成1mol水时放热57.3kJ |
| B、含1mol H2SO4的稀硫酸与足量稀NaOH溶液中和后,放热为57.3 kJ |
| C、1L 0.1mol/L CH3COOH与1L 0.1mol/L NaOH溶液反应后放热为5.73 kJ |
| D、1L 0.1 mol/L HNO3与1L 0.1mol/L NaOH溶液反应后放热为5.73 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、Cl-、NO3- |
| B、Al3+、Ca2+、SO42-、Br- |
| C、NH4+、K+、HSO3-、CO32- |
| D、Na+、K+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
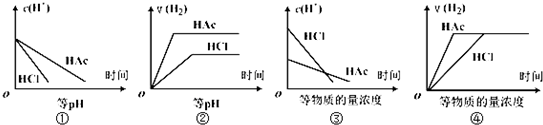
| A、①②③ | B、②④ |
| C、①③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molH2含有的电子数 |
| B、通常状况下,22.4LCO2所含的分子数 |
| C、0.012kg12C所含的原子数 |
| D、1LO.5mol?L-1的CaCl2溶液所含的Cl-数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2Fe+3Cl2
| ||||
B、Fe2O3+3CO
| ||||
| C、CaO+CO2═CaCO3 | ||||
| D、H2SO4+2NaOH═Na2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用乙醇萃取碘水中的碘 |
| B、用通入适量O2并点燃的方法除去CO2中混有的少量CO杂质 |
| C、向煮沸的1 mol?L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| D、向混有碳酸钾的氯化钾溶液中加入适量的盐酸,除去其中的碳酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com