
”¾ĢāÄæ”æ¢ń.ČēĶ¼ĖłŹ¾£¬¼×”¢ŅŅÖ®¼äµÄøō°åKŗĶ»īČūF¶¼æÉ×óÓŅŅĘ¶Æ£¬¼×ÖŠ³äČė2molAŗĶ1molB£¬ŅŅÖŠ³äČė2molCŗĶ1molHe£¬“ĖŹ±KĶ£ŌŚ0“¦”£ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśæÉÄę·“Ó¦£ŗ2A£Øg£©+B£Øg£©![]() 2C£Øg£©£»·“Ó¦“ļµ½Ę½ŗāŗó£¬ŌŁ»Öø“ÖĮŌĪĀ¶Č”£»Ų“šĻĀĮŠĪŹĢā£ŗ
2C£Øg£©£»·“Ó¦“ļµ½Ę½ŗāŗó£¬ŌŁ»Öø“ÖĮŌĪĀ¶Č”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©æÉøł¾Ż _______________ĻÖĻóĄ“ÅŠ¶Ļ¼×ŅŅ¶¼ŅŃ“ļµ½Ę½ŗāדĢ¬”£
£Ø2£©“ļµ½Ę½ŗāŹ±£¬øō°åK×īÖÕĶ£ĮōŌŚ0æĢ¶Č×ó²ąa“¦£¬ŌņaµÄȔֵ·¶Ī§ŹĒ___________________”£
£Ø3£©Čō“ļµ½Ę½ŗāŹ±£¬øō°åK×īÖÕĶ£ĮōŌŚ×ó²ąæĢ¶Č1“¦£¬“ĖŹ±¼×ČŻ»żĪŖ2L£¬·“Ó¦»ÆŃ§Ę½ŗā³£ŹżĪŖ______________£Ø“ųµ„Ī»£©
¢ņ.ČōŅ»æŖŹ¼¾Ķ½«K”¢FČēĶ¼¹Ģ¶Ø£¬ĘäĖūĢõ¼ž¾ł²»±ä£¬Ōņ“ļµ½Ę½ŗāŹ±£ŗ
£Ø1£©²āµĆ¼×ÖŠAµÄ×Ŗ»ÆĀŹĪŖb£¬ŌņŅŅÖŠCµÄ×Ŗ»ÆĀŹĪŖ _________________ £»
£Ø2£©¼ŁÉčŅŅ”¢¼×Į½ČŻĘ÷ÖŠµÄŃ¹Ēæ±ČÓĆd±ķŹ¾£¬ŌņdµÄȔֵ·¶Ī§ŹĒ ____________________ ”£
”¾“š°ø”æ »īČūKŗĶF²»ŌŚŅĘ¶Æ 0<a<2 4L/moL 1-b 4/3<d<3/2
”¾½āĪö”æŹŌĢā·ÖĪö£ŗ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬¼«ĻŽ·ØµÄŹ¹ÓĆ£¬»ÆŃ§Ę½ŗāµÄ±źÖ¾£¬ŗćĪĀŗćČŻĻĀµÄµČŠ§Ę½ŗā¹ęĀÉ”£
I£Ø1£©¼×”¢ŅŅÖ®¼äµÄøō°åKŗĶ»īČūF¶¼æÉ×óÓŅŅĘ¶Æ£¬ĖµĆ÷¼×ŅŅ¶¼ŹĒŗćŃ¹ČŻĘ÷”£·“Ó¦2A£Øg£©+B£Øg£©![]() 2C£Øg£©ŹĒÕż·“Ó¦ĪŖĘųĢå·Ö×ÓŹż¼õŠ”µÄ·“Ó¦£¬½ØĮ¢Ę½ŗāµÄ¹ż³ĢÖŠĘųĢåĪļÖŹµÄĮæ·¢Éś±ä»Æ£¬ĘųĢåĢå»ż·¢Éś±ä»Æ£¬øō°åKŗĶ»īČūF·¢ÉśŅĘ¶Æ£¬Ę½ŗāŹ±ĘųĢåĪļÖŹµÄĮæ²»±ä£¬øō°åKŗĶ»īČūF²»ŌŁŅĘ¶Æ”£øł¾Żøō°åKŗĶ»īČūF²»ŌŁŅʶÆÅŠ¶Ļ¼×ŅŅ¶¼ŅŃ¾“ļµ½Ę½ŗāדĢ¬”£
2C£Øg£©ŹĒÕż·“Ó¦ĪŖĘųĢå·Ö×ÓŹż¼õŠ”µÄ·“Ó¦£¬½ØĮ¢Ę½ŗāµÄ¹ż³ĢÖŠĘųĢåĪļÖŹµÄĮæ·¢Éś±ä»Æ£¬ĘųĢåĢå»ż·¢Éś±ä»Æ£¬øō°åKŗĶ»īČūF·¢ÉśŅĘ¶Æ£¬Ę½ŗāŹ±ĘųĢåĪļÖŹµÄĮæ²»±ä£¬øō°åKŗĶ»īČūF²»ŌŁŅĘ¶Æ”£øł¾Żøō°åKŗĶ»īČūF²»ŌŁŅʶÆÅŠ¶Ļ¼×ŅŅ¶¼ŅŃ¾“ļµ½Ę½ŗāדĢ¬”£
£Ø2£©ÓĆ¼«ĻŽ·Ø£¬Čō¼×ÖŠAŗĶB²»·“Ó¦£¬øō°åKĶ£ĮōŌŚ0æĢ¶Č£»Čō¼×ÖŠAŗĶBĶźČ«·“Ó¦ŌņÉś³É2molC£¬øł¾ŻŗćĪĀŗćŃ¹ĻĀĘųĢåĢå»żÖ®±ČµČÓŚĘųĢåĪļÖŹµÄĮæÖ®±Č£¬£Ø2mol+1mol£©£ŗ2mol=6£ŗV£¬V=4£¬Ōņøō°åKĶ£ĮōŌŚ0æĢ¶Č×ó²ą2“¦£»ÓÉÓŚŹĒæÉÄę·“Ó¦ŌņaµÄȔֵ·¶Ī§2![]() a
a![]() 0ӣ
0ӣ
£Ø3£©Čō“ļµ½Ę½ŗāŹ±£¬øō°åK×īÖÕĶ£ĮōŌŚ×ó²ąæĢ¶Č1“¦£¬ÉčæŖŹ¼µ½Ę½ŗā¹ż³ĢÖŠ×Ŗ»ÆµÄBµÄĪļÖŹµÄĮæĪŖx£¬ÓĆČż¶ĪŹ½
2A£Øg£©+B£Øg£©![]() 2C£Øg£©
2C£Øg£©
n£ØĘšŹ¼£©£Ømol£© 2 1 0
n£Ø×Ŗ»Æ£©£Ømol£© 2x x 2x
n£ØĘ½ŗā£©£Ømol£© 2-2x 1-x 2x
øł¾ŻŗćĪĀŗćŃ¹ĻĀĘųĢåµÄĢå»żÖ®±ČµČÓŚĘųĢåĪļÖŹµÄĮæÖ®±ČĮŠŹ½3£ŗ£Ø2-2x+1-x+2x£©=6£ŗ5£¬½āµĆx=0.5mol£¬ŌņĘ½ŗāŹ±A”¢B”¢CµÄĪļÖŹµÄĮæŅĄ“ĪĪŖ1mol”¢0.5mol”¢1mol£¬ČŻ»żĪŖ2L£¬Ę½ŗāŹ±A”¢B”¢CµÄĪļÖŹµÄĮæÅضČŅĄ“ĪĪŖ0.5mol/L”¢0.25mol/L”¢0.5mol/L£¬»ÆŃ§Ę½ŗā³£Źż=c2£ØC£©/[c2£ØA£©”¤c£ØB£©]=£Ø0.5mol/L£©2/[£Ø0.5mol/L£©2![]() 0.25mol/L]=4L/mol”£
0.25mol/L]=4L/molӣ
IIČōŅ»æŖŹ¼¾Ķ½«K”¢FČēĶ¼¹Ģ¶Ø£¬ĘšŹ¼¼×ŅŅÖŠĘųĢåĪļÖŹµÄĮ涼ŹĒ3mol£¬Ōņ¼×ŅŅŹĒŗćĪĀŗćČŻĒŅĢå»żĻąµČµÄČŻĘ÷”£
£Ø1£©ŅŅÖŠĘ½ŗāµÄ½ØĮ¢æÉĄķ½ā³É£ŗĻČŌŚÓė¼×µČĢå»żµÄŅŅČŻĘ÷ÖŠ¼ÓČė2molC“ļµ½Ę½ŗā£¬Ī¬³ÖĪĀ¶ČČŻ»ż²»±äŌŁ³äČė1molHe”£ŅŅÖŠ¼ÓČė2molC£¬²ÉÓĆŅ»±ßµ¹¼«ĻŽ»»ĖćŗóĪŖ2molAŗĶ1molB£¬ŌŚŗćĪĀŗćČŻŹ±¼×ÖŠ¼ÓČė2molAŗĶ1molBÓėŅŅÖŠ¼ÓČė2molC“ļµ½Ę½ŗāŹ±»„ĪŖĶźČ«Č«µČµÄµČŠ§Ę½ŗā£¬²āµĆ¼×ÖŠAµÄ×Ŗ»ÆĀŹĪŖb£¬ŌņŅŅÖŠCµÄ×Ŗ»ÆĀŹĪŖ1-b£»ŅŅŗćĪĀŗćČŻĘ½ŗāŗóŌŁ¼ÓČė1molHe£¬ÓÉÓŚø÷ĪļÖŹµÄÅضČƻӊ·¢Éś±ä»Æ£¬»ÆŃ§Ę½ŗā²»ŅĘ¶Æ£¬ŅŅÖŠCµÄ×Ŗ»ÆĀŹČŌĪŖ1-b”£“š°øĪŖ£ŗ1-b”£
£Ø2£©ŌŚŗćĪĀŗćČŻČŻĘ÷ÖŠŃ¹ĒæÖ®±ČµČÓŚĘųĢåĪļÖŹµÄĮæÖ®±Č”£ÓĆ¼«ĻŽ·Ø£¬Čō¼×ÖŠAŗĶBƻӊ·“Ó¦£¬¼×ÖŠĘųĢå×ÜĪļÖŹµÄĮæĪŖ3mol£¬ŅŅŗĶ¼×»„ĪŖµČŠ§Ę½ŗā£¬ŌņŅŅÖŠĘųĢå×ÜĪļÖŹµÄĮæĪŖ3mol+1mol£Ø1molĪŖHe£©=4mol£¬“ĖŹ±ŅŅ”¢¼×ÖŠµÄŃ¹Ēæ±Čd=4/3£»Čō¼×ÖŠAŗĶBĶźČ«·“Ó¦£¬Ę½ŗāŹ±¼×ÖŠĘųĢå×ÜĪļÖŹµÄĮæĪŖ2mol£¬ŅŅŗĶ¼×»„ĪŖµČŠ§Ę½ŗā£¬ŌņŅŅÖŠĘųĢå×ÜĪļÖŹµÄĮæĪŖ2mol+1mol£Ø1molĪŖHe£©=3mol£¬“ĖŹ±ŅŅ”¢¼×ÖŠµÄŃ¹Ēæ±Čd=3/2£»ŌņŅŅ”¢¼×Į½ČŻĘ÷ÖŠµÄŃ¹Ēæ±ČdµÄȔֵ·¶Ī§ŹĒ4/3<d<3/2”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½üÄźĄ“øßĢśĖį¼Ų(K2FeO4)ŅŃ¾±»¹ć·ŗÓ¦ÓĆŌŚĖ®“¦Ąķ·½Ćę£¬øßĢśĖį¼ŲµÄŃõ»ÆŠŌ³¬¹żøßĆĢĖį¼Ų£¬ŹĒŅ»ÖÖ¼ÆŃõ»Æ”¢Īüø½”¢Äż¾Ū”¢É±¾śÓŚŅ»ĢåµÄŠĀŠĶøߊ§¶ą¹¦ÄÜĖ®“¦Ąķ¼Į”£øÉŌļµÄøßĢśĖį¼ŲŹÜČČŅ×·Ö½ā£¬µ«ŌŚ198”ęŅŌĻĀŹĒĪČ¶ØµÄ”£øßĢśĖį¼ŲŌŚĖ®“¦Ąķ¹ż³ĢÖŠÉę¼°µÄ±ä»Æ¹ż³ĢÓŠ£ŗ¢Łµ°°×ÖŹµÄ±äŠŌ ¢Śµ°°×ÖŹµÄŃĪĪö ¢Ū½ŗĢå¾Ū³Į ¢ÜŃĪĄąĖ®½ā ¢ŻŃęÉ«·“Ó¦ ¢ŽŃõ»Æ»¹Ō·“Ó¦
A. ¢Ł¢Ś¢Ū¢Ü¢ŻB. ¢Ł¢Ū¢Ü¢ŽC. ¢Ś¢Ū¢Ü¢ŻD. ¢Ś¢Ū¢Ż¢Ž
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖŅŅĖį£ØHA£©µÄĖįŠŌ±Č¼×Ėį£ØHB£©Čõ£¬ŌŚĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0.1mol/LµÄNaAŗĶNaB»ģŗĻČÜŅŗÖŠ£¬ĻĀĮŠÅÅŠņÕżČ·µÄŹĒ£Ø £©
A. c(OH£)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ
A£®·²ÄÜ·¢ÉśŅų¾µ·“Ó¦µÄÓŠ»śĪļŅ»¶ØŹĒČ©
B£®ŌŚŃõĘųÖŠČ¼ÉÕŹ±Ö»Éś³ÉCO2ŗĶH2OµÄĪļÖŹŅ»¶ØŹĒĢž
C£®±½·ÓÓŠČõĖįŠŌ£¬Ė×³ĘŹÆĢæĖį£¬Ņņ“ĖĖüŹĒŅ»ÖÖōČĖį
D£®ŌŚõ„»Æ·“Ó¦ÖŠ£¬ōČĖįĶŃČ„ōČ»łÖŠµÄōĒ»ł£¬“¼ĶŃČ„ōĒ»łÖŠµÄĒā¶ųÉś³ÉĖ®ŗĶõ„
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠ£¬ŗ¬ÓŠ·Ē¼«ŠŌ¼üµÄĄė×Ó»ÆŗĻĪļŹĒ( )
A. CaCl2 B. H2O2 C. HCl D. Na2O2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆĖłŃ§ÖŖŹ¶ĢīŠ“ĻĀĮŠæÕ°×£ŗ£ØĢī“śŗÅ£©
£Ø1£©ĻĀĮŠĪļÖŹ£ŗ¢Ł½šŹōĶ ¢Ś¹ĢĢ¬NaCl ¢ŪŅŗŃõ ¢ÜŃĪĖį ¢ŻĢ¼°ō ¢Ž¾Ę¾« ¢ßKOHĖ®ČÜŅŗ ¢ąČŪȌדĢ¬µÄKNO3 ¢įĘĻĢŃĢĒ ¢āĢģČ»Ęų
ŹōÓŚµē½āÖŹµÄŹĒ__________£»ŹōÓŚ·Ēµē½āÖŹŹĒ__________£»Äܵ¼µēµÄ»ÆŗĻĪļŹĒ__________”£
£Ø2£©³£ĪĀĻĀ£¬½«1mLpH=1µÄH2SO4µÄČÜŅŗ¼ÓĖ®Ļ”ŹĶµ½100mL£¬Ļ”ŹĶŗóµÄČÜŅŗÖŠc(SO42-)”Ćc(OH-) =_______________£»
£Ø3£©Ä³ĪĀ¶ČŹ±£¬²āµĆ0.01 molL-1 NaOHČÜŅŗµÄpHĪŖ11£¬ŌņøĆĪĀ¶ČĻĀĖ®µÄĄė×Ó»ż³£ŹżKw=______”£ŌŚøĆĪĀ¶ČĻĀ£¬½«pH=aµÄNaOHČÜŅŗVa LÓėpH=bµÄĮņĖįVb L»ģŗĻ.ČōĖłµĆ»ģŗĻŅŗĪŖÖŠŠŌ£¬ĒŅa=12£¬b=2£¬ŌņVa£ŗVb=______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲĀČŌŖĖŲ¼°Ęä»ÆŗĻĪļµÄ±ķŹ¾ÕżČ·µÄŹĒ£Ø £©
A.ÖŹ×ÓŹżĪŖ17”¢ÖŠ×ÓŹżĪŖ20µÄĀČŌ×Ó£ŗ ![]() Cl
Cl
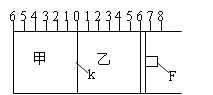
B.ĀČĄė×Ó£ØCl©£©µÄ½į¹¹Ź¾ŅāĶ¼£ŗ 
C.ĀČ·Ö×ӵĵē×ÓŹ½£ŗ ![]()
D.ĀČ»ÆĒāµÄ½į¹¹Ź½£ŗH©Cl
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ[2017½ĖÕ] H2O2·Ö½āĖŁĀŹŹÜ¶ąÖÖŅņĖŲÓ°Ļģ”£ŹµŃé²āµĆ70”ꏱ²»Ķ¬Ģõ¼žĻĀH2O2ÅضČĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
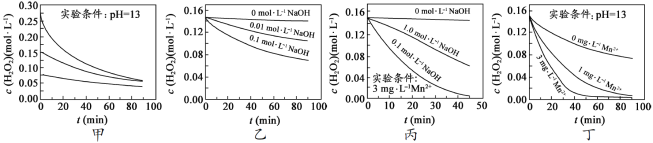
A£®Ķ¼¼×±ķĆ÷£¬ĘäĖūĢõ¼žĻąĶ¬Ź±£¬H2O2ÅضČŌ½Š”£¬Ęä·Ö½āĖŁĀŹŌ½æģ
B£®Ķ¼ŅŅ±ķĆ÷£¬ĘäĖūĢõ¼žĻąĶ¬Ź±£¬ČÜŅŗpHŌ½Š”£¬H2O2·Ö½āĖŁĀŹŌ½æģ
C£®Ķ¼±ū±ķĆ÷£¬ÉŁĮæMn 2+“ęŌŚŹ±£¬ČÜŅŗ¼īŠŌŌ½Ē棬H2O2·Ö½āĖŁĀŹŌ½æģ
D£®Ķ¼±ūŗĶĶ¼¶”±ķĆ÷£¬¼īŠŌČÜŅŗÖŠ£¬Mn2+¶ŌH2O2·Ö½āĖŁĀŹµÄÓ°Ļģ“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓƶčŠŌµē¼«µē½āĻĀĮŠČÜŅŗ£¬Ņ»¶ĪŹ±¼äŗó£¬ŌŁ¼ÓČėŅ»¶ØÖŹĮæµÄĮķŅ»ĪļÖŹÖŠ£ØĄØŗÅÄŚ£©£¬ČÜŅŗÄÜÓėŌĄ“ČÜŅŗĶźČ«Ņ»ŃłµÄŹĒ
A.CuCl2 [H2O]B.NaOH [NaOH]C.NaCl [Cl2]D.CuSO4 [CuO]
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com