
| A. | 原子半径C>A>B>D | B. | 价电子数D>C>A>B | ||
| C. | 离子半径C3+>D->B+>A2+ | D. | 单质的还原性A>B>C>D |
分析 短周期元素的离子:aA2+、bB+、cC3+、dD-都具有相同的电子层结构,所以有:a-2=b-1=c-3=d+1,且A、B、C在周期表中D的下一周期,原子序数:c>a>b>d,A、B、C为金属,D为非金属.结合元素周期律递变规律解答该题.
解答 解:短周期元素的离子:aA2+、bB+、cC3+、dD-都具有相同的电子层结构,所以有:a-2=b-1=c-3=d+1,且A、B、C在周期表中D的下一周期,原子序数:c>a>b>d,A、B、C为金属,D为非金属.
A.A、B、C在周期表中D的下一周期,并且原子序数:c>a>b>d,原子核外电子层数越多,半径越大,同周期元素原子序数越大,半径越小,则有原子半径:B>A>C>D,故A错误;
B.aA2+、bB+、cC3+、dD-都具有相同的电子层结构,其价电子分别为2、1、3、7,所以价电子数D>C>A>B,故B正确;
C.aA2+、bB+、cC3+、dD-都具有相同的电子层结构,核电荷数越大,离子半径越小,核电荷数c>a>b>d,所以离子半径D>B>A>C,故C错误;
D.同周期自左而右,金属性减弱,单质还原性减弱,则单质的还原性B>A>C,D为非金属,则单质的还原性:B>A>C>D,故D错误;
故选B.
点评 本题考查元素周期表及微粒性质比较,把握核外电子排布确定元素所在周期表中的位置及元素性质的递变规律是解答该题的关键,侧重分析与应用能力的考查,题目难度不大.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度,促进CO32-水解,pH减小 | |
| B. | 离子浓度:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| C. | 离子浓度:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(H+)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的单晶硅可用于制造太阳能电池板和光导纤维 | |
| B. | 石油可以通过裂解、裂化等物理变化获得重要化工原料乙烯 | |
| C. | 鸡蛋清和淀粉溶液都属于胶体,遇到硫酸铜溶液可以发生胶体聚沉 | |
| D. | 植物油中由于含有碳碳双键,因此在空气中长时间放置容易氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述II |
| A | 油脂和汽油都是油 | 一定条件下都能发生皂化反应 |
| B | CuSO4可以用作游泳池消毒剂 | 铜盐能使蛋白质变性 |
| C | 蔗糖、淀粉、纤维素是还原性糖 | 它们一定条件下都能发生银镜反应 |
| D | 蛋白质结构中存在肽键 | 蛋白质能表现出两性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
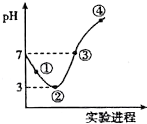 常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 用pH试纸测①处c(H+)约为②处c (H+)的两倍 | |
| B. | 可依据②处数据计算所溶解的n(Cl2) | |
| C. | ③处表示溶液中,c(Na+)=c(ClO-)+c(Cl-) | |
| D. | 曲线③④段有离子反应:HClO+OH-→ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
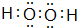 ,其所含化学键为(选代码)bc.
,其所含化学键为(选代码)bc.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油分馏和煤干馏都是物理变化 | |
| C. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ | |
| C. | 由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 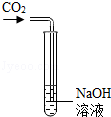 检验生成的气体是CO2 | B. | 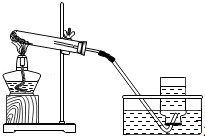 加高锰酸钾制氧气 | ||
| C. | 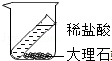 验证质量守恒定律 | D. | 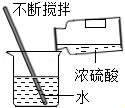 实验室稀释浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com