
| A. | W的离子半径>Y的离子半径 | |
| B. | Z的氢化物稳定性<W的氢化物稳定性 | |
| C. | Y的氧化物既能与盐酸,又能与NaOH溶液反应 | |
| D. | X2W2、Y2W3两种化合物含有的化学键类型完全相同 |
分析 只有W显负价,应为O元素,Y3+与W的阴离子具有相同的电子层结构,Y为Al元素,X、Y的最外层电子数之和与Z的最高正价数相等,可知该硅酸盐中,Z应为Si元素,X的化合价为+1价,X、W的质子数之和等于Y、Z的质子数之和,则X为K元素,以此解答该题.
解答 解:只有W显负价,应为O元素,Y3+与W的阴离子具有相同的电子层结构,Y为Al元素,X、Y的最外层电子数之和与Z的最高正价数相等,可知该硅酸盐中,Z应为Si元素,X的化合价为+1价,X、W的质子数之和等于Y、Z的质子数之和,则X为K元素,该硅酸盐为KAlSi3O8,
A.O2-与Al3+具有相同的核外电子排布,核电荷数越小离子半径越大,故A正确;
B.非金属性O>Si,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.Al2O3为两性氧化物,既能与盐酸反应,又能与NaOH溶液反应,故C正确;
D.K2O2、Al2O3两种化合物都为离子化合物,K2O2含有离子键和共价键,而Al2O3只含有离子键,故D错误.
故选D.
点评 本题考查学生利用原子结构的关系来推断元素,利用物质的结构和性质来分析解答问题,推断元素是解答本题的难点,题中最外层电子数以及原子序数的关系解答该题的关键,答题时要注意,应学会利用假设和验证的方法来解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于稀硫酸中:Al+2H+═A13++H2↑ | |
| B. | 少量Cl2通入KI溶液中:Cl2+2I-═2C1-+I2 | |
| C. | 醋酸钠水溶液中通入足量CO2:2CH3COO-+CO2+H2O═2CH3COOH+CO32- | |
| D. | 碳酸锌溶于稀硝酸中:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为34 | |
| B. | 最高价氧化物的水化物的分子式为:H2SeO4 | |
| C. | Se的非金属性比Br强 | |
| D. | 气态氢化物的稳定性比硫化氢气体弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe→Cu | +0.78 |
| Zn | Zn→Cu | +1.10 |
| A | Cu→A | -0.15 |
| B | B→Cu | +0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,其中含有的化学键类型为离子键、非极性键
,其中含有的化学键类型为离子键、非极性键查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(SO42-)>c(NH4+)>c(Al3+) | |
| B. | x=20时溶液导电能力比x=15时溶液导电能力强 | |
| C. | x=25时,溶液中主要有Ba2+、AlO2-,c(Ba2+)>c(AlO2-) | |
| D. | x=30时的离子方程式:NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3•H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  研究的是温度、压强对平衡的影响,横坐标表示压强 | |
| B. | 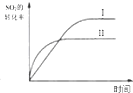 研究的是温度对平衡的影响,Ⅱ采用的温度更高 | |
| C. | 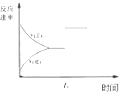 图中t0时使用了催化剂,使平衡向正反应方向进行 | |
| D. | 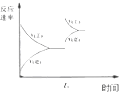 图中t0时增大压强,使平衡向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①③ | B. | 仅②③ | C. | 仅①② | D. | 仅③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com