
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 4 | ⑧ | ⑨ | ⑩ |
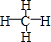 ;其中心原子采取sp3杂化,空间构型为正四面体.
;其中心原子采取sp3杂化,空间构型为正四面体. 分析 根据元素在周期表中的位置知,①~⑩号元素分别是C、O、F、Si、S、Cl、Ar、K、Ga、Br元素,
(1)同一主族元素,元素的金属性随着原子序数增大而增强,同一周期元素,元素的金属性随着原子序数增大而减弱;同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,元素第一电离能随着原子序数增大而减弱;同一周期元素,元素的电负性随着原子序数增大而增大,同一主族元素,元素的电负性随着原子序数增大而减弱;
(2)在 ①~⑩元素的最高价氧化物的水化物呈两性的是氢氧化铝;⑥是Cl元素,其最高价氧化物的水化物是高氯酸;
(3)①形成的气态氢化物是甲烷,根据价层电子对互斥理论确定分子空间构型及原子杂化方式.
解答 解:据元素在周期表中的位置知,①~⑩号元素分别是C、O、F、Si、S、Cl、Ar、K、Ga、Br元素,
(1)同一主族元素,元素的金属性随着原子序数增大而增强,同一周期元素,元素的金属性随着原子序数增大而减弱,元素周期表中金属性最强的元素位于周期表左下角,所以这几种元素金属性最强的是K元素;同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,元素第一电离能随着原子序数增大而减弱,这几种元素中第一电离能最小的是K元素;
同一周期元素,元素的电负性随着原子序数增大而增大,同一主族元素,元素的电负性随着原子序数增大而减弱,这几种元素中电负性最大的是F元素;
故答案为:K;K;F;
(2)在 ①~⑩元素的最高价氧化物的水化物呈两性的是Al(OH)3;⑥是Cl元素,其最高价氧化物的水化物是高氯酸,化学式为HClO4;
故答案为:Al(OH)3;HClO4;
(3)①形成的气态氢化物的甲烷,其结构式为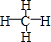 ,甲烷分子中C原子价层电子对个数是4且不含孤电子对,所以为sp3杂化,为正四面体结构,
,甲烷分子中C原子价层电子对个数是4且不含孤电子对,所以为sp3杂化,为正四面体结构,
故答案为: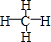 ;sp3;正四面体.
;sp3;正四面体.
点评 本题考查元素周期表和元素周期律的综合应用,侧重考查周期表结构、原子杂化、微粒空间构型、元素周期律等知识点,知道价层电子对互斥理论内涵,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④②③① | C. | ②④③① | D. | ④①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
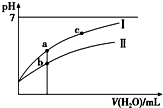 已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( ) | CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CH3OH)/mol | n(CH3OCH3)/mo |
| 0 | 2.05 | 0 |
| t1 | 0.6 | |
| t2 | 0.05 |
| A. | 反应在t2 min时v正≠v逆 | |
| B. | 反应达到平衡时,放出的热量为50 kJ | |
| C. | 反应在t1 min内的平均速率为v(CH3OH)=$\frac{0.6}{{t}_{1}}$mol•L-1•min-1 | |
| D. | 若反应达到平衡后,缩小容器体积,$\frac{c(C{H}_{3}OC{H}_{3})}{c(C{H}_{3}OH)}$变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
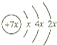 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离、提纯→确定分子式→确定实验式→确定结构式 | |
| B. | 分离、提纯→确定实验式→确定分子式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定实验式→确定分子式 | |
| D. | 确定分子式→确定实验式→确定结构式→分离、提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 操作II中,通入硫化氢至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化 | |
| B. | 在溶液中用硫酸酸化至pH=2的目的防止Fe2+沉淀 | |
| C. | 操作Ⅰ所得滤液中可能含有Fe3+ | |
| D. | 常用标准KMnO4溶液滴定的方法测定绿矾产品中Fe2+的含量,滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com