
| A. | 新制Cu(OH)2浊液可鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液 | |
| B. | 用无水乙醇、冰醋酸、3mol/L硫酸制乙酸乙酯 | |
| C. | 苯、溴水、铁粉混合制成溴苯 | |
| D. | 可用分液漏斗分离甘油和水 |
分析 A.乙醇、乙醛、乙酸、甲酸分别与新制Cu(OH)2浊液反应的现象不同;
B.3mol/L硫酸是稀硫酸;
C.苯与溴水不反应;
D.乙醇与水互溶.
解答 解:A.乙醇、乙醛、乙酸、甲酸分别与新制Cu(OH)2浊液反应的现象为:无现象、生成砖红色沉淀、生成蓝色溶液、加热先有蓝色溶液后生成砖红色沉淀,现象不同,可以鉴别,故A正确;
B.3mol/L硫酸是稀硫酸,应用浓硫酸,故B错误;
C.苯与溴水不反应,苯、液溴、铁粉混合制成溴苯,故C错误;
D.乙醇与水互溶,在分液漏斗中不分层,所以不能用分液漏斗分离乙醇和水,故D错误.
故选A.
点评 本题综合考查化学实验方案的评价,侧重于物质的检验、制备和分离的考查,题目难度不大,注意把握相关实验的注意事项以及相关物质的性质.


科目:高中化学 来源: 题型:解答题
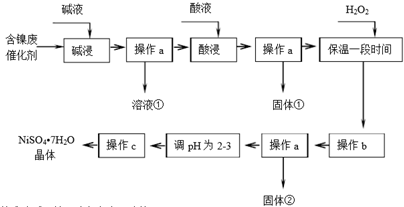
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.8 | 2.7 | 7.6 | 7.1 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2或SO2都会导致酸雨的形成 | |
| B. | 苯与溴水在铁催化下可发生取代反应 | |
| C. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| D. | 电解水生成H2和O2的实验中,可加入少量盐酸增强导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Cl- | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中①组的反应只可能有一种元素被氧化和一种元素被还原 | |
| B. | 表②中若生成标准状况下6.72LCl2,转移电子数为0.6NA | |
| C. | 由表中①②组反应推测:ClO3-、Br-、H+、Fe2+不能在浓溶液中大量共存 | |
| D. | 表中③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冶炼过程中的尾气可用来制硫酸 | |
| B. | 上述过程中,由1molCuFeS2制取1molCu时共消耗2molO2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量为32g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
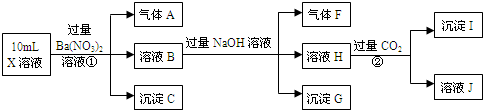
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Fe(0H)2+O2+2H2O═4Fe(OH)3 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | 4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | D. | 2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com