
 合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:| x |
| 1 |
| c2(NH3) |
| c(N2)?c3(H2) |
| (2x)2 |
| (1-x)×(3-3x)3 |
| 4α甲2 |
| 27(1-α甲)4 |
| 4α甲2 |
| 27(1-α甲)4 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液绿色,稀溶液蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
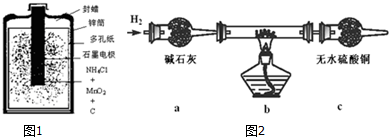
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 10.4 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 12.4 | 5.2 | 完全溶解:10.8 |
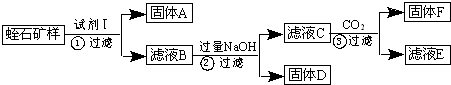

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动了 |
| B、物质A的转化率减少了 |
| C、容器体积增加可以是向其中充入了惰性气体 |
| D、a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入0.01 mol?L-1的CH3COOH溶液 |
| B、加入CH3COONa固体 |
| C、稀释 |
| D、加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 烧杯中装有100mLH2SO4和Na2SO4的混合液,其浓度分别为0.16mol/L和2mol/L,欲使其浓度分别变为1.6mol/L和0.2mol/L,在只有蒸馏水和18mol/L浓H2SO4以及必要仪器的条件下,完成任务:
烧杯中装有100mLH2SO4和Na2SO4的混合液,其浓度分别为0.16mol/L和2mol/L,欲使其浓度分别变为1.6mol/L和0.2mol/L,在只有蒸馏水和18mol/L浓H2SO4以及必要仪器的条件下,完成任务:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com