
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是

A.金属性:甲>乙>丁
B.原子半径:辛>戊>甲
C.丙与庚的元素原子核外电子数相差13
D.形成的最简单氢化物的稳定性:己>戊
C
【解析】
试题分析:戊是自然界中硬度最大的单质,则戊是金刚石,对应的元素是C元素;所以甲是第一主族元素Li,乙是Na,丙是K元素,丁是Ca元素,己是Si元素,庚是Ge元素,辛是Ga元素。A、甲与乙是同主族元素,所以从上到下,元素的金属性逐渐增强,则金属性乙>甲,错误;B、甲与戊是同周期元素,则原子半径随核电荷数的增加而减小,所以原子半径甲>戊,错误;C、丙是K元素,原子序数是19,庚是Ge元素,原子序数是32,所以丙与庚的元素原子核外电子数相差13,正确;D、戊的非金属性大于己,所以戊的气态氢化物的稳定性大于己的氢化物的稳定性,错误,答案选C。
考点:考查元素的推断,元素周期表和元素周期律的应用


科目:高中化学 来源:2014-2015江苏省宿迁市高二下学期学业水平模拟化学试卷(解析版) 题型:选择题
二氧化氯(Cl02)是一种常用的杀菌消毒剂。从物质分类的角度來看,二氧化氯属于
A.盐 B.酸 C.有机物 D.氧化物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:填空题
(15分)运用化学反应原理分析解答以下问题
(1)250℃时,以镍合金为催化剂,向4L容器中通人6 mol CO2、6 molCH4 ,发生如下反应:CO2(g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=___________.
②若再向容器中同时充入2.0molCO2、6.0 molCH4 、4.0 molCO和8.0 molH2 ,则上述平衡向_____(填“正反应”或“逆反应”)方向移动。
,则上述平衡向_____(填“正反应”或“逆反应”)方向移动。
(2)硝化法是 一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
已知:① NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH= —41.8KJ·mol-1
SO3(g)+NO(g) ΔH= —41.8KJ·mol-1
②2SO2(g)+O2(g)  2SO3(g) ΔH= —196.6KJ·mol-1
2SO3(g) ΔH= —196.6KJ·mol-1
①写出NO和O2反应生成NO2的热化学方程式__________。
②一定温度下,向2L恒容密闭容器中充人NO2和SO2各1 mol,5min达到平衡,此时容器中NO和NO2的浓度之比为3:1,则NO2的平衡转化率是_________。
(3)常温下有浓度均为0.1 mol/L的四种溶液:①Na2CO3、②NaHCO3、③HCl、④NH3.H2O。
①有人称溶液①是油污的“清道夫”,原因是_________(用离子方程式解释)
②上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为__________。
③向④中加入少量氯化铵固体,此时c(NH4+)/ c(OH-)的值_________(填“ 增大”“减小”或“不变”)。 ④若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
增大”“减小”或“不变”)。 ④若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
⑤将10 mL溶液③加水稀释至100 mL,则 此时溶液中由水电离出的c( H+)=___________。
此时溶液中由水电离出的c( H+)=___________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:填空题
(12分)前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等,D与C同周期,且C中未成对电子是该周期中最多的;D基态原子的2p电子是2s电子的2倍;E有4个电子层,且与A最外层电子数相同,其他各层均排满。
(1)写出E2+的基态核外电子排布式 。
(2)A和C可以形成18电子的分子,该分子中C原子的杂化方式为 。
(3)C与D形成的酸根离子CD3-
①CD3-的空间构型为 (用文字描述)。
②写出一种与CD3-互为等电子体的分子的化学式 。
(4)CA3的沸点比BA4的沸点高的原因是 。
(5)E2+与C的常见氢化物形成配位数为4的配合物离子,1mol该离子中含σ键数目为 。
(6)E晶胞结构如图所示,该晶体中每个E原子周围距离最近的E原子数目为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
25 ℃时,下列溶液中微粒的物质的量浓度关系正确的是
A.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+ 2c(H2CO3)
B.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa混合液(pH<7):c(CH3COOH)>c(CH3COO-)>c (Na+)>c(H+)>c(OH-)
C.浓度均为0.1 mol·L-1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3)
D.向0.1 mol/L NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c (OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列物质性质与应用对应关系均正确的是
A.SO2具有漂白性,可用SO2加工银耳,使之更白
B.炭具有强还原性,常用于冶炼镁、钠等金属
C.淀粉遇碘变蓝色,常用于检验食盐是否为加碘盐
D.NaHCO3可以与胃酸反应,可用NaHCO3治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:填空题
(15分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下:
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是 。
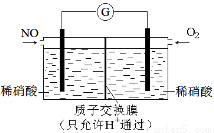
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。

(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:选择题
下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管 中加入0.1mol/L H2SO4溶液 | 试管口出现红棕色 气体 | 溶液中NO3—被 Fe2+还原为NO2 |
B | 向饱和Na2CO3溶液中通入足 量CO2 | 溶液变浑浊 | 析出Na2CO3晶体 |
C | 等体积pH=2的HX和HY两 种酸分别与足量的铁反应,排 水法收集气体 | HX放出的氢气多且 反应速率快 | HX酸性比HY弱 |
D | 先向2mL0.1mol/LNa2S溶液中 滴几滴0.1mol/LZnSO4溶液,再 加入几滴0.1mol/LCuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | Ksp(ZnS)<Ksp(CuS) |
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:填空题
(10分)某海域海水一些化学成分如下表
海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
含量/mol·L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
已知:25℃时,Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=1.8×10-11。
某化学小组同学欲在实验制备MgCl2,并提取Zn。设计流程如下:

[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH为8.0,其原因是(写离子方程式) 。
(2)下图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图。

请结合图中数据回答:
试剂X的化学式为 ;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH的范围为 。
(3)同学们发现,把MgCl2溶液蒸发、灼烧所得的白色固体难溶解于水,于是认为其主要成分是MgO。你认为 (填“正确”、“不正确”),原因是(用化学方程式表示) 、 。
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com