
| A. | 逸出SO3气体 | B. | 逸出SO2气体 | ||
| C. | 析出BaO3沉淀 | D. | 析出BaSO4沉淀和BaSO3沉淀 |
分析 混合气体中含有SO3,将生成的气体通入BaCl2溶液中发生:SO3+H2O=H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,注意H2SO3酸性小于HCl.
解答 解:强热条件下,硫酸亚铁固体可发生如下反应:2FeSO4$\frac{\underline{\;加热\;}}{\;}$Fe2O3+SO2↑+SO3↑,混合气体中含有SO3,将生成的气体通入BaCl2溶液中发生:SO3+H2O=H2SO4,则没有SO3逸出;H2SO4+BaCl2=BaSO4↓+2HCl,则有BaSO4沉淀生成;
由于H2SO3酸性小于HCl和H2SO4,则SO2不能与BaCl2溶液反应而从溶液中逸出,故得不到BaSO3沉淀,所以B符合.
故选B.
点评 本题考查二氧化硫的性质,题目难度中等,本题注意SO3和SO2性质的区别,注意H2SO3酸性小于HCl和H2SO4,则不能与BaCl2溶液反应,得不到BaSO3沉淀.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O所含的水分子数为NA | |
| B. | 常温常压下,16 g氧气所占的体积为11.2 L | |
| C. | 同温同压下,1 mol任何物质所占的体积相等 | |
| D. | 标准状况下,2NA个二氧化碳分子所占的体积为44.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羧酸的官能团是羟基 | |
| B. | 羟基和氢氧根中含有的电子数不同 | |
| C. | 在氧气中燃烧只生成二氧化碳和水的有机物一定是烃 | |
| D. | 乙醇与钠反应生成氢气,此现象说明乙醇具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池的放电反应 | B. | 铝与氧化铁在高温下的反应 | ||
| C. | 明矾的水解反应 | D. | 炭与CO2的化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
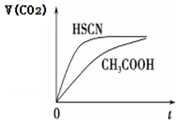 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
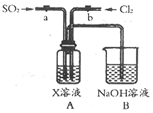 设计用图装置探究二氧化硫、氯气的化学性质通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
设计用图装置探究二氧化硫、氯气的化学性质通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在密闭容器中发生反应:X+2Y?2Z(△H<0),其中Z显气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图,下列判断正确的是( )
在密闭容器中发生反应:X+2Y?2Z(△H<0),其中Z显气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图,下列判断正确的是( )| A. | Y一定呈气态 | |
| B. | T1大于T2 | |
| C. | 升高温度,该反应的化学平衡常数增大 | |
| D. | 当c(X):c(Y):c(Z)=1:2:2时,反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
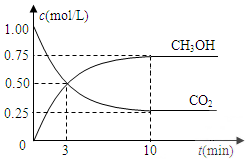 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积固定为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积固定为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com