
分析 (1)发生反应:2KBr+Cl2=2KCl+Br2、2KI+Cl2=2KCl+I2,氯气足量,KBr、KI完全反应,加热蒸发、灼烧,Br2挥发,I2升华,最终得到的固体为KCl;
(2)根据n=$\frac{m}{M}$计算KCl的物质的量,根据n=cV计算KI的物质的量,由K元素守恒可知,n(KBr)+n(KI)=n(KCl),再根据m=nM计算KBr的质量;
(3)根据氯元素守恒n(Cl)=$\frac{1}{2}$n(Cl2)=n(KCl),据此求消耗氯气的体积;
解答 解:(1)发生反应:2KBr+Cl2=2KCl+Br2、2KI+Cl2=2KCl+I2,氯气足量,KBr、KI完全反应,加热蒸发、灼烧,Br2挥发,I2升华,最终得到的固体为KCl,
答:固体残留物中含有KCl;
(2)KCl的物质的量=$\frac{6.1g}{74.5g/mol}$×2=0.16mol,KI的物质的量=2×0.036L×0.86mol/L=0.062mol,由K元素守恒可知:n(KBr)=n(KCl)-n(KI)=0.16mol-0.062mol=0.098mol,故m(KBr)=0.098mol×119g/mol=11.7g,
答:原溶液中含有KBr的质量为11.7g;
(3)根据氯元素守恒n(Cl)=$\frac{1}{2}$n(Cl2)=n(KCl),则n(Cl2)=2n(KCl)=2×0.16mol=0.32mol,V(Cl2)=n(Cl2)×Vm=0.32mol×22.4L/mol=7.168L.
答:反应完全时消耗Cl2的体积是7.168L.
点评 本题考查化学方程式的计算、混合物计算,难度不大,判断蒸发灼烧后的固体成分是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
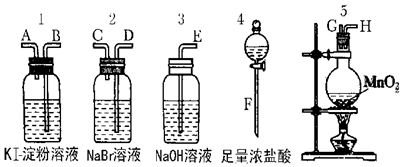
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
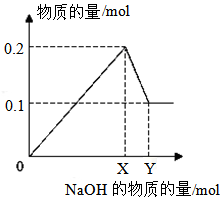 I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.
I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.配制0.10mol•L-1 NaOH溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2,分出水层后的操作 | D.定容 |
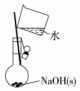 | 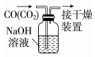 | 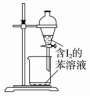 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
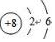 .A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)
.A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示) _.
_.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com