
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源:2017届山东省日照市高三上学期期中化学试卷(解析版) 题型:推断题
W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊、庚是由其中的两种、三种或四种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体,丁为强碱。已知反应:①甲+乙→丁+己,②庚→乙+丙+戊。
完成下列问题:
(1)元素X在周期表中的位置为______________。
(2)元素Y、Z的简单离子的半径大小顺序为r(___________)>r(__________)。(填化学符号)
(3)化合物甲中的阴阳离子的个数比为______________。
(4)质量为a g的甲与足量的乙完全反应转移的电子数为__________。(用NA表示阿伏加德罗常数的值)
(5)写出反应“丁+庚→乙+戊”的离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上11月月考化学卷(解析版) 题型:填空题
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。
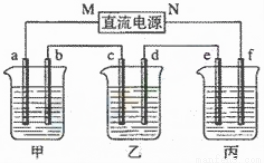
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
① 电源的N端为______________极;
② 电极b上发生的电极反应为_______________;
③ 列式计算电极b上生成的气体在标准状况下的体积_____________(保留小数点后一位);
④ 电极c的质量变化是____________g;
⑤ 电解前后各溶 液的PH变化(填“增大”、“减小”、“不变”),简述其原因:
液的PH变化(填“增大”、“减小”、“不变”),简述其原因:
甲溶液______________________;
乙溶液______________________;
丙溶液______________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上模拟四化学卷(解析版) 题型:选择题
下列叙述中,正确的是( )
A.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
B.在加入铝粉能放出氢气的溶液中:K+、NH4+、NO3-、Cl- 一定能够大量共存
C.利用食醋除去热水瓶水垢中CaCO3的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O
D.除去乙酸乙酯中的少量乙酸:加入过量的NaOH溶液,静置分层后,除去水层
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:填空题
试回答下列问题:
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:_____________。
(2)日常生活中常用的“84消毒液”的主要成分是NaClO,而洁厕灵的主要成分是HCl,两者不能混合使用,请用离子方程式表示原因_______________________。
(3)取300 mL 0.2 mol/L KI溶液与一定量的酸性KMnO4溶液恰好完全反应,生成等物质量的I2和KIO3,则消耗KMnO4的物质的量为________mol
(4) 在Na2S2O3的溶液中加入稀硫酸石到的现象是:______________,写出该反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
下列实验过程始终无明显现象的是
A. CO2气体通入Ba(NO3)2溶液中 B. NO2气体通入FeSO4溶液中
C. H2S气体通入CuSO4溶液中 D. HCl气体通入NaSiO3溶液中
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:填空题
化学反应原理在生产和生 活中有广泛的应用。
活中有广泛的应用。
Ⅰ.NO2与SO2都是形成酸雨的主 要物质。在一定条件下,两者能发生反应:
要物质。在一定条件下,两者能发生反应:
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
(1)在一定条件下,将等物质的量的NO2、SO2气体置于体积固定的密闭容器中发生反应,下列能说明反应已经达到平衡状态的是
a.v(NO2)生成=v(SO2)消耗
b.混合气体的总压强不再改变
c.容器内气体颜色不再改变
d.容器内气体平均相对分子质量不再改变
(2)科学家正在研究利用催化技术将NO2和CO转变成无害的CO2和N2,反应的化学方程式:
2NO2(g)+4CO(g)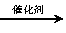 4CO2(g)+N2(g)+Q(Q>0)
4CO2(g)+N2(g)+Q(Q>0)
若在密闭容器中充入NO2和CO,下列措施能提高NO2转化率的是 。
A.选用高效催化剂 B.充入NO2 C.降低温度 D.加压
Ⅱ.(1)17℃、1.01×105Pa,在2L密闭容器NO2和N2O4的混合气体达到平衡时,NO2的物质的量为0.2mol,N2O4的体积分数为6/11。计算该条件下反应2NO2(g) N2O4(g)的平衡常数K= 。若此时向容器中再充入0.1mol NO2和0.12mol N2O4,原化学平衡 移动(填“正向”、“逆向”或“不”)。
N2O4(g)的平衡常数K= 。若此时向容器中再充入0.1mol NO2和0.12mol N2O4,原化学平衡 移动(填“正向”、“逆向”或“不”)。
(2)现用一定量的Cu与足量的浓HNO3反应,制得2.20L(已折算到标准状况)已达到平衡的NO2 和N2O4的混合气体,理论上至少需消耗Cu g(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl- 六种粒子。其中N2的物质的量随时间变化的曲线如图所示。 下列判断正确的是
下列判断正确的是
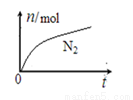
A.该反应的还原剂是Cl-
B.消耗1 mol还原剂,转移6 mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海省高二11月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.增大反应物浓度能增大有效碰撞的几率
B.增加压强能增大反应物活化分子的百分数
C.增加反应物浓度能增大反应物活化分子的百分数
D.分解反应都是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com