
【题目】常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LH2X溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列说法正确的是
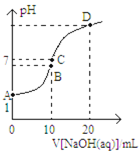
A.水电离出来的c(OH):D点<B点
B.C点存在关系式:c(Na+)=c(HX)+2c(X2)c(H+)
C.B点:c(Na+)>c(HX)>c(H+)>c(X2)>cH2X)
D.A点溶液中加入少量水:![]() 减小
减小
【答案】C
【解析】
A. D点溶质为Na2X,水解显碱性,B点溶质为NaHX,HX-的电离大于水解,溶液显酸性,抑制水的电离,因此水电离出来的c(OH):D点>B点,故A错误;
B. C点溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-),溶液呈中性即c(H+)=c(OH-),存在关系式:c(Na+)=c(HX)+2c(X2),故B错误;
C. B点溶质为NaHX,HX-的电离大于水解,溶液显酸性,离子浓度大小关系为:c(Na+)>c(HX)>c(H+)>c(X2)>cH2X),故C正确;
D. A点溶液中加入少量水,促进H2X的电离,由于溶液体积也增大,c(HX)减小,则![]() 增大,故D错误;
增大,故D错误;
综上所述,答案为C。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】某学习小组在实验室用二氧化锰和浓盐酸共热制备并收集纯净、干燥的氯气,并进行氯气性质的探究。
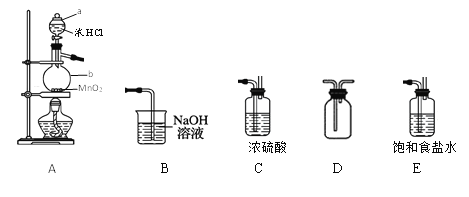
(1)仪器a、b的名称是____。
(2)以上装置A、B、C、D、E从左到右的连接顺序为____________。
(3)如何检查装置A的气密性?____。
(4)装置A中发生反应的离子方程式为____。
(5)装置B的作用是___,有同学觉得此装置不够完善,请你提出改进意见_____。
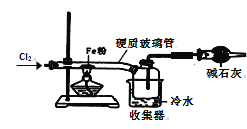
(6)该小组同学设计如图所示装置探究氯气的氧化性。通入氯气时硬质玻璃管中的现象是__,原因是__(用化学方程式解释)。
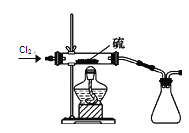
(7)二氯化硫(S2Cl2)在工业上用于橡胶的硫化。为了在实验室合成S2Cl2,该小组用下图装置将干燥的氯气在110~140℃与硫反应,即可得S2Cl2粗品。写出发生反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质 A、B 和气体甲、乙、丙以及物质 C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
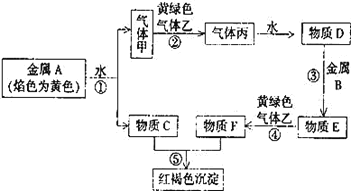
请回答下列问题:
(1) A 的化学式为_____,F 的化学式为_____;
(2) 写出 C 溶液与 Al 反应的离子方程式_____。
(3) 写出 C 溶液与黄绿色气体乙反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某氟化稀土样品中氟元素的质量分数进行如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量,实验装置如图所示。

(1)c的名称是________________
(2)检查装置气密性:在b和f中加水,水浸没导管a和e末端,______________(填操作步骤),微热c,容量瓶f有气泡冒出,导管a内形成一段水柱;停止加热,_________________________,说明装置气密性良好。
(3)c中加入一定体积高氯酸和m g氟化稀土样品,f中盛有滴加酚酞的NaOH溶液。加热b、c,使水蒸气进入c。
①向c中通水蒸气的目的是________________________________;
②c中除有HF气体外,可能还有少量SiF4(易水解)气体生成,若有SiF4生成,实验结果将__________(填“偏高”“偏低”或”不受影响”)。
③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因_______________________________。
(4)向馏出液中加入V1ml c1 mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用c2 mol·L-1 EDTA标准溶液滴定剩余的La3+(La3+与EDTA按1:1络合),消耗EDTA标准溶液V2 mL,则氟化稀土样品中氟的质量分数为____________(写出表达式即可,不需化简)。
(5)用样品进行实验前,需要用0.084g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏实验),测量并计算出氟元素质量,重复多次。该操作的目的是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是
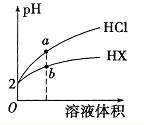
A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制MgCl2晶体中常含有杂质Fe2+,在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好采用的是_________(填下面的选项),加入该氧化剂时,温度不能太高,原因是_________。
A.KMnO4 B.H2O2 C.HNO3 D.氯水
然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液pH可选用下列中的有_________。
A.Mg2(OH)2CO3 B.MgO C.NH3·H2O D.Mg(OH)2
某溶液中含Mg2+和Fe3+,c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?_________(FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24)
(2)常温下Ksp[Fe(OH)3]=8.0×1038,Ksp[Cu(OH)2]=3.0×1020,通常认为残留在溶液中的离子浓度小于1×105molL1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL1,为除去溶液中的Fe3+而不影响Cu2+,溶液的pH的范围为_________。(已知lg5=0.7)。
(3)矿物中各种原生铜的硫化物经氧化、淋滤后可变成CuSO4溶液,并向内部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),可慢慢转化为铜蓝(CuS)。写出硫酸铜与ZnS反应的离子方程式为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是维持人体生命活动所必需的营养物质,下列叙述不正确的是( )
A.将碘酒滴到土豆片上,土豆片变蓝,说明碘元素均遇淀粉变蓝
B.工业上常用油脂在碱性条件下的水解反应来制肥皂
C.加热条件下,葡萄糖溶液能与新制![]() 悬浊液反应产生砖红色沉淀
悬浊液反应产生砖红色沉淀
D.蛋白质在浓硝酸作用下能发生颜色反应,可用来鉴别部分蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光。该草酸二酯的结构简式如下图所示。下列有关该草酸二酯的说法不正确的是
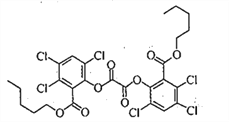
A. 分子中含有一种含氧官能团
B. 苯环上的一溴代物只有一种
C. 可以发生取代反应和加成反应
D. lmol草酸二酯与NaOH溶液反应最多消耗4mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过实验得出的结论正确的是
A.某溶液中加入酸性KMnO4溶液褪色,则原溶液一定含有I-
B.某固体试样加水溶解,取上层清液,加KSCN溶液出现红色,原固体中一定含Fe3+
C.通过元素分析测定某无机固体样品的组成是MgH2C2O6,该固体不可能是碱式碳酸镁
D.某碱性水样滴加稀盐酸无沉淀,再加BaCl2溶液,出现白色沉淀,则原水样中一定含![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com