
| A. | 一定存在的离子为Fe3+、SO42- | |
| B. | 一定不存在的离子为CO32-、I- | |
| C. | 不能确定的离子为K+、SO42- | |
| D. | 确定是否含有K+离子需要经过焰色反应 |
分析 取样,滴加KSCN溶液后显血红色,则溶液中一定存在Fe3+,溶液中一定不存在与Fe3+反应的CO32-、I-;根据溶液电中性可知,溶液中一定存在SO42-,不能确定是否含有钾离子,是否含有K+离子需要经过焰色反应,据此进行解答.
解答 解:滴加KSCN溶液后显血红色,则溶液中一定存在Fe3+,溶液中一定不存在与Fe3+反应的CO32-、I-;根据溶液电中性可知,溶液中一定存在SO42-,不能确定是否含有钾离子,是否含有K+离子需要经过焰色反应,
A.根据分析可知,溶液中一定存在Fe3+、SO42-,故A正确;
B.溶液中一定存在Fe3+,溶液中一定不存在与Fe3+反应的CO32-、I-,故B正确;
C.溶液中一定含有SO42-,故C错误;
D.无法确定是否含有钾离子,若确定是否含有K+离子需要经过焰色反应,故D正确;
故选C.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
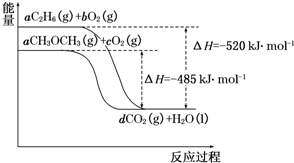 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.如图是乙烷(C2H6)、二甲醚(CH3OCH3)燃烧过程的能量变化图.请回答下列问题:
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.如图是乙烷(C2H6)、二甲醚(CH3OCH3)燃烧过程的能量变化图.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+、SCN-、Cl- | B. | Fe3+、Na+、S2-、Cl- | ||
| C. | K+、H+、Cl-、AlO2- | D. | Na+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
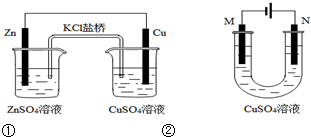
| A. | 装置①中盐桥内的K+移向CuSO4溶液 | |
| B. | 装置①将电能转变为化学能 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则N极为粗铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com