
| A. | 同质量的气体A与气体B,所含分子数目之比为a:b | |
| B. | 气体A与气体B的摩尔质量之比为a:b | |
| C. | 相同条件下,a g气体A与b g气体B体积之比为b:a | |
| D. | 相同条件下,气体A与气体B的密度之比为b:a |
分析 同温同压下,气体摩尔体积相同,同温同压下的a g气体A与b g气体B的分子数目相同,说明二者的物质的量相等,则A、B的摩尔质量之比等于其质量之比为a:b,
A.根据N=nNA=$\frac{m}{M}{N}_{A}$,相同质量时其分子数之比等于摩尔质量的反比;
B.通过以上分析知,A、B的摩尔质量之比等于其质量之比;
C.相同条件下气体摩尔体积相同,根据V=nVm=$\frac{m}{M}{V}_{m}$计算其体积之比;
D.相同条件下气体摩尔体积相同,根据ρ=$\frac{M}{{V}_{m}}$知,其密度之比等于摩尔质量之比.
解答 解:同温同压下,气体摩尔体积相同,同温同压下的a g气体A与b g气体B的分子数目相同,说明二者的物质的量相等,则A、B的摩尔质量之比等于其质量之比为a:b,
A.根据N=nNA=$\frac{m}{M}{N}_{A}$,相同质量时其分子数之比等于摩尔质量的反比,所以其分子数之比=$\frac{mg}{ag/mol}{N}_{A}$:$\frac{mg}{bg/mol}{N}_{A}$=b:a,故A错误;
B.通过以上分析知,A、B的摩尔质量之比等于其质量之比,为a:b,故B正确;
C.相同条件下气体摩尔体积相同,根据V=nVm=$\frac{m}{M}{V}_{m}$知,其体积之比=$\frac{ag}{ag/mol}{V}_{m}$:$\frac{bg}{bg/mol}{V}_{m}$=1:1,
故C错误;
D.相同条件下气体摩尔体积相同,根据ρ=$\frac{M}{{V}_{m}}$知,其密度之比等于摩尔质量之比,为a:b,故D错误;
故选B.
点评 本题考查物质的量计算,为高频考点,侧重考查学生分析、计算能力,明确各个物理量之间的关系是解本题关键,注意气体摩尔体积适用范围及适用条件,难点是D中密度与摩尔质量关系公式的推导,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
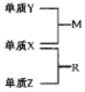 X、Y、Z是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系,其中 R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
X、Y、Z是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系,其中 R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )| A. | X元素位于周期表中第16列 | |
| B. | X、Y、Z元素两两之间均能形成原子个数比为1:1的化合物 | |
| C. | X、Y、Z元素形成的单质均具有强还原性 | |
| D. | R的沸点高于M的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
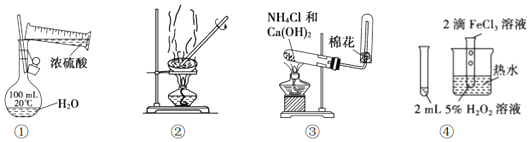
| A. | 用装置①配制一定浓度的硫酸溶液 | |
| B. | 用装置②分离溶解在CCl4中的 I2 | |
| C. | 用装置③制备和收集少量 NH3 | |
| D. | 用装置④验证FeCl3对 H2O2分解有催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na>Mg | B. | 酸性:H2SO4>H2SiO3 | ||
| C. | 稳定性:HCl>HBr | D. | 同浓度溶液的碱性:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
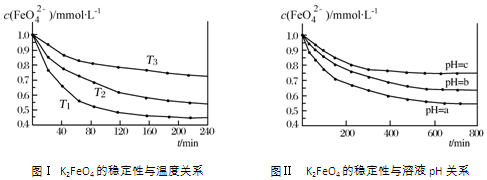
| A. | 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱 | |
| B. | 由图Ⅰ可知温度:T1>T2>T3 | |
| C. | 由图Ⅰ可知上述反应△H<0 | |
| D. | 由图Ⅱ可知图中a<c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

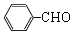 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2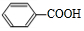 .
. +
+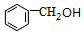 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$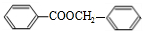 +H2O.
+H2O.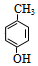 .
.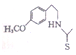 也能发生类似反应④的环化反应,VII的环化产物的结构简式
也能发生类似反应④的环化反应,VII的环化产物的结构简式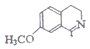 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
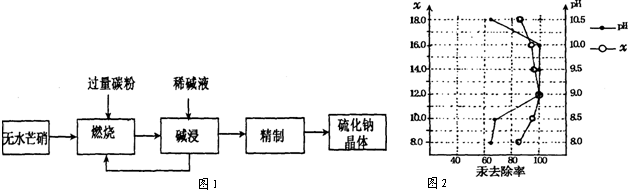
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
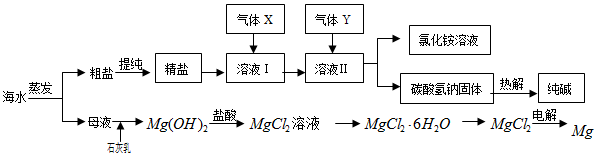
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com