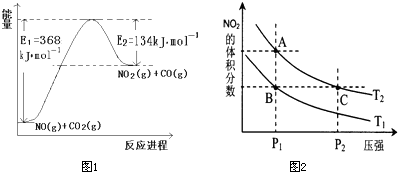
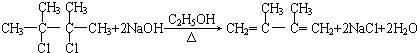(2012?延边州模拟)如图1为长式周期表的一部分,其中的编号代表对应元素.

请回答下列问题:
(1)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
BD
BD
.
A.分子中含有氢键
B.属于含有极性键的非极性分子
C.只含有4个σ键和1个π键
D.该氢化物分子中元素②原子采用sp
2杂化
(2)科学发现,②、⑤、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构如图2所示(图中②、⑤、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
MgNi3C
MgNi3C
(用对应的元素符号表示).
(3)a:比较②、③、④三种元素第一电离能大小,由小到大排列的顺序为
C<O<N
C<O<N
(用元素符号表示).
b:比较④、⑥、⑦、⑧四种元素的电负性大小,由大到小排列的顺序为
O>Cl>S>Al
O>Cl>S>Al
(用元素符号表示).
(4)某元素的价电子排布式为ns
nnp
n+1,该元素与元素①形成的18电子的X分子的结构式为
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为:
先生成蓝色沉淀,后沉淀溶解,溶液呈深蓝色
先生成蓝色沉淀,后沉淀溶解,溶液呈深蓝色
;反应过程中的离子方程式为
Cu2++2 NH3?H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
Cu2++2 NH3?H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
.
(5)⑩元素单质晶体是面心立方体,立方体的每个面5个⑩原子紧密堆砌,⑩原子半径为d cm,该金属的密度为
g?cm
-3.(该金属原子的质量为a g)




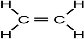 ,可知分子中含有C=C非极性键和C-H极性键,为平面形分子,含有5个σ键和1个π键,每个C形成3个σ键,为sp2杂化,
,可知分子中含有C=C非极性键和C-H极性键,为平面形分子,含有5个σ键和1个π键,每个C形成3个σ键,为sp2杂化, ,与元素①形成10电子的气体分子Y为NH3,氨气通入铜盐溶液中,先生成蓝色沉淀,继续反应生成配合物,反应的离子方程式为Cu2++2 NH3?H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
,与元素①形成10电子的气体分子Y为NH3,氨气通入铜盐溶液中,先生成蓝色沉淀,继续反应生成配合物,反应的离子方程式为Cu2++2 NH3?H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-, ;先生成蓝色沉淀,后沉淀溶解,溶液呈深蓝色;Cu2++2 NH3?H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
;先生成蓝色沉淀,后沉淀溶解,溶液呈深蓝色;Cu2++2 NH3?H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;