
| A. | CaCl2和(NH4)2SO4 | B. | (NH4)2SO4和(NH4)2CO3 | ||
| C. | NaOH和CaCl2 | D. | NaOH和(NH4)2SO4 |
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:选择题
 隔膜电解法是一种处理高浓度乙醛废水的新方法,乙醛分别在阴、阳极发生反应转化为乙醇和乙酸.实验室以一定浓度的乙醛-硫酸钠溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
隔膜电解法是一种处理高浓度乙醛废水的新方法,乙醛分别在阴、阳极发生反应转化为乙醇和乙酸.实验室以一定浓度的乙醛-硫酸钠溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 若以氢氧燃料电池为直流电源,燃料电池的b极应通入空气 | |
| B. | 电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 | |
| C. | 阳极反应CH3CHO-2e-+2H+═CH3COOH+H2O | |
| D. | 电解过程中,由于硫酸钠不参与电极反应,故阳极区始终c(Na+)=2 c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合如图所示关系,其中甲和X可能是( )
甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合如图所示关系,其中甲和X可能是( )| A. | 甲为C、X为O2 | B. | 甲为Fe、X为Cl2 | C. | 甲为N2、X为O2 | D. | 甲为NaOH、X为SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| C(H+)mol•L-1 | C(OH-)mol•L-1 | PH | |
| 溶液1 | 1×10-4 | 1×10-10 | 4 |
| 溶液2 | 1×10-7 | 1×10-7 | 7 |
| 溶液3 | 1×10-9 | 1×10-5 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
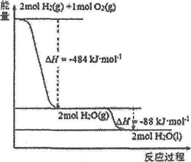 已知:H-H、O=O的键能分别是436kJ•mol-1和496kJ•mol-1.依据图,则H-O的键能是( )
已知:H-H、O=O的键能分别是436kJ•mol-1和496kJ•mol-1.依据图,则H-O的键能是( )| A. | 926 kJ•mol-1 | B. | 485 kJ•mol-1 | C. | 463 kJ•mol-1 | D. | 221 kJ•moI-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .向饱和食盐水中应先通入气体氨气(填气体名称),再通入气体O=C=O(填气体的结构式)才能得到物质D,其原因是先通氨气使溶液碱性增强,能溶解更多的二氧化碳,生成较多的碳酸氢钠,使碳酸氢钠晶体析出.
.向饱和食盐水中应先通入气体氨气(填气体名称),再通入气体O=C=O(填气体的结构式)才能得到物质D,其原因是先通氨气使溶液碱性增强,能溶解更多的二氧化碳,生成较多的碳酸氢钠,使碳酸氢钠晶体析出.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com