
| A. | NaOH | B. | HCl | C. | NaCl | D. | Na2CO3 |
分析 在25℃时,某稀溶液中由水电离产生的c(H+)=10-5mol/L>10-7mol/L,说明该溶液中水的电离受到促进,则溶液中的溶质为水解的盐,据此分析解答.
解答 解:在25℃时,某稀溶液中由水电离产生的c(H+)=10-5mol/L>10-7mol/L,说明该溶液中水的电离受到促进,则溶液中的溶质为水解的盐,
A.氢氧化钠是碱抑制水的电离,故A错误;
B.HCl是酸抑制水的电离,故B错误;
C.NaCl是强酸强碱盐,温度不变,水的离子积常数不变,水的电离不受影响,故C错误;
D.碳酸钠是强碱弱酸盐,碳酸根离子结合水电离出的氢离子,促进水的电离,故D正确;
故选D.
点评 本题考查弱电解质的电离,根据水的电离程度确定溶液中的溶质,注意水的离子积常数只与温度有关,与溶液酸碱性或浓度无关,为易错点,题目较简单.


科目:高中化学 来源: 题型:解答题
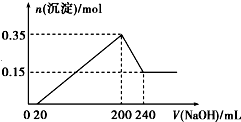
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
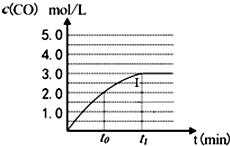 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤代反应 | B. | 加聚反应 | C. | 酯化反应 | D. | 消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
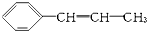 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为 | |
| D. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 充电过程是电能转化为化学能的过程 | |
| C. | 放电时负极附近溶液的碱性不变 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
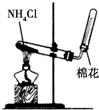 |  | 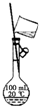 | 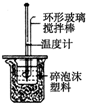 |
| A.实验室制取氨气 | B.测定反应速率装置 | C.配制100 mL 0.1 mol/L盐酸 | D.测定中和反应的反应热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
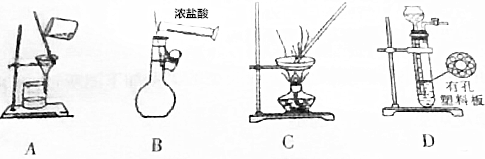
| A. | 用图a所示装置用除去淀粉溶液中的NaCl | |
| B. | 用图b所示装置配制100mL0.100mol•L-1稀盐酸 | |
| C. | 图c所示装置可用于从碘水中分离出I2 | |
| D. | 图d所示装置可用于CaCO3和稀盐酸制取少量的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com