
某次酸雨的分析数据如下:c(NH4+)=2.0×10-5 mol/L,c(Cl-)=6.0×10-5 mol/L,c(Na+)=1.9×10-5 mol/L,c(NO3-)=2.3×10-5 mol/L,c(SO42-)=2.8×10-5 mol/L,则此次酸雨的pH大约为( )
A.3 B.4 C.5 D.6
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源:2017届安徽省六校教育研究会高三上第一次联考化学卷(解析版) 题型:选择题
用来解释下列事实的离子方程式正确的是
A.钢铁发生吸氧腐蚀的正极反应:O2+4e—+2H2O=4OH—
B.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe(OH)3+3H2O
C.用铜为电极电解饱和食盐水:2Cl—+2H2O Cl2↑+H2↑+2OH—
Cl2↑+H2↑+2OH—
D.碳酸氢钠溶液中加入过量石灰水:HCO3—+OH—=CO32—+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一11月月考化学卷(解析版) 题型:选择题
对下列离子组共存情况的判断正确的是( )
A.使石蕊溶液变红的澄清透明溶液中Fe3+、MnO4-、Na+、SO42-能大量共存
B.使酚酞溶液变红的溶液中Na+、AlO2-、NO3-、HCO3-能大量共存
C.加入铝粉产生H2的溶液中Na+、Ba2+、AlO2-一定可以大量存在
D.含大量Fe3+的溶液中K+、NH4+、SO42-、SCN-能大量共存
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:选择题
分子式为C8H18的烷烃中,含有4个甲基的同分异构体的数目是( )
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:选择题
25℃时,在20 ml 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如图所示,有关粒子浓度的关系中,不正确的是( )
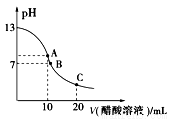
A.在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B.在 B点:c(Na+)﹦c(CH3
B点:c(Na+)﹦c(CH3 COO-)﹥c(OH-)﹦c(H+)
COO-)﹥c(OH-)﹦c(H+)
C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+)﹥c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)﹦2c(Na+)
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:实验题
新切开的苹果在空气中放置一段时间表面会变黄,最终变成褐色,这种现象在食品科学上通常称为“褐变”。 关于苹果褐变的原因有以下两种说法:为____________
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究。
实验用品:苹果、浓度均为0.1mol·L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水。
(1)探究1:
实验操作 | 实验现象 | 结论 |
在“褐变”后的苹果上滴上2~3滴 溶液。 | _________________ | 说法A不正确 |
(2)探究2:【查阅文献】Ⅰ.苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5。Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色。
该小组将刚削皮的苹果切成七块,分别进行如下实验。请填写下表中相应的结论:
序号 | 实验步骤 | 现 象 |
|
① | 在一块上滴加2至3滴FeCl3溶液 | 表面变为绿色 | ______________ |
② | 再取两块,一块放置于空气中,另一块迅速浸入经过去氧的蒸馏水中。 | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化。 | 苹果褐变与_________有关 |
③ | 另两块分别立刻放入沸水和0.1mol·L–1盐酸中浸 | 相当长一段时间内,两块均无明显变化。 | 苹果褐变与酚氧化酶的活性有关 |
④ | 最后两块分别立刻放入浓度均为0.1mol·L–1的NaHCO3和Na2SO3溶液里浸泡2min后取出,置于空气中。 | 前者经过一段时间表面逐渐褐变,后者相当长一段时间内,无明显变化。 | 亚硫酸钠溶液能阻止苹果褐变 |
(3)问题分析:Ⅰ、常温下,浓度均为0.1 mol· L-1 NaHC O3溶液略显碱性,而NaHSO3溶液却略显酸性。 NaHSO3溶液略显酸性是因为 。
O3溶液略显碱性,而NaHSO3溶液却略显酸性。 NaHSO3溶液略显酸性是因为 。
Ⅱ、0.1mol· L–1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因 : 。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
下列表达式正确的是
A.热化学反应方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(l)△H=-57.3kJ·mol-1
B.用碳电极电解CuSO4溶液离子反应方程式:2Cu2++2H2O 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
C.用电子式表示H2O中化学键形成过程:H2+O→H:O:H
D.过量的CO2通入NaAlO2溶液的化学方程式:2NaAlO2+CO2+3H2O=Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源:2017届山东省日照市高三上学期期中化学试卷(解析版) 题型:推断题
W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊、庚是由其中的两种、三种或四种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体,丁为强碱。已知反应:①甲+乙→丁+己,②庚→乙+丙+戊。
完成下列问题:
(1)元素X在周期表中的位置为______________。
(2)元素Y、Z的简单离子的半径大小顺序为r(___________)>r(__________)。(填化学符号)
(3)化合物甲中的阴阳离子的个数比为______________。
(4)质量为a g的甲与足量的乙完全反应转移的电子数为__________。(用NA表示阿伏加德罗常数的值)
(5)写出反应“丁+庚→乙+戊”的离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上11月月考化学卷(解析版) 题型:填空题
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。
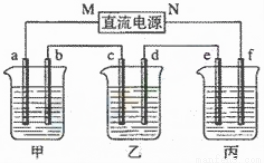
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
① 电源的N端为______________极;
② 电极b上发生的电极反应为_______________;
③ 列式计算电极b上生成的气体在标准状况下的体积_____________(保留小数点后一位);
④ 电极c的质量变化是____________g;
⑤ 电解前后各溶 液的PH变化(填“增大”、“减小”、“不变”),简述其原因:
液的PH变化(填“增大”、“减小”、“不变”),简述其原因:
甲溶液______________________;
乙溶液______________________;
丙溶液______________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com