
| A. | 氨 | B. | 二氧化碳 | C. | 过氧化钠 | D. | 次氯酸 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键、非金属元素之间易形成共价键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,第IA族、第IIA族和第VIA族、第VIIA族元素之间易形成离子键.
解答 解:A.氨中氢原子和氮原子之间存在极性共价键,故A错误;
B.二氧化碳中碳原子和氧原子之间存在极性共价键,故B错误;
C.Na2O2中钠离子和过氧根离子之间以离子键结合,过氧根离子中氧原子和氧原子之间以非极性共价键结合,所以Na2O2中含有非极性共价键、离子键,故C正确;
D.次氯酸中钠离子和次氯酸根离子之间存在离子键,次氯酸根离子氯与氧之间是极性共价键,故D错误.
故选C.
点评 本题考查了离子键、非极性共价键和极性共价键的判断,根据这几个概念的内涵来分析解答即可,注意离子键、共价键的区别,注意并不是所有物质中都含有化学键,稀有气体不含化学键,为易错点.


科目:高中化学 来源: 题型:解答题

 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$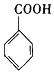
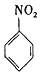 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (苯胺,易被氧化)
(苯胺,易被氧化) .
. .
. .
. 最合理的方案(不超过3步).
最合理的方案(不超过3步). $→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$
$→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH是只含离子键的离子化合物 | |
| B. | HCl溶于水没有破坏共价键 | |
| C. | 碳在O2中燃烧时,破坏碳和O2中化学键吸收的总能量大于形成CO2中化学键释放的总能量 | |
| D. | 在Cl2+2NaBr=2NaCl+Br2反应过程中有离子键和共价键的断裂,也有离子键和共价键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与H2化合时X单质比Y单质容易 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 在氧化还原反应中,甲失的电子比乙多 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.
A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X、Z、W各自最高和最低化合价的代数和分别为1、4、6 | |
| B. | 原子半径的大小为Y>Z>W | |
| C. | 元素的非金属性顺序为W>Z>X | |
| D. | Y和其他3种元素均能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
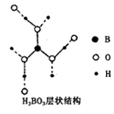 正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )| A. | 含1 mol H3BO3的晶体中有6 mol氢键 | |
| B. | 分子中硼原子、氧原子最外层均为8e-的稳定结构 | |
| C. | 正硼酸晶体属于原子晶体 | |
| D. | H3BO3分子的稳定性与氢键无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若c(Fe2+)与c(Cu2+)相等时,该反应达到平衡状态 | |
| B. | 向平衡体系中加入少量硫酸铜晶体后,FeS的KSP减小 | |
| C. | 其他条件不变,增大FeS的物质的量,该反应的正反应速率增大 | |
| D. | 该反应的化学平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com