
下列有关盐类水解的叙述中正确的是( )
A.溶液呈中性的盐一定是强酸、强碱生成的盐
B.含有弱酸根盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱
D.强酸强碱盐的水溶液一定呈中性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
根据信息回答下列问题:
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
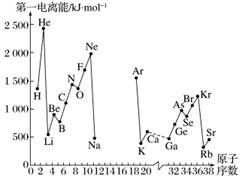
B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第三周期Na~Ar这几种元素中,Al的第一电离能的大小范围为______<Al<______(填元素符号)。
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是________________。
(3)信息A图中第一电离能最小的元素在周期表中的位置是________周期________族。
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有________性,其中Be(OH)2显示这种性质的离子方程式是________________________________________________________________________。
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围________________。
(6)请归纳元素的电负性和金属性、非金属性的关系是________________。
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物,说出理由并写出判断的方法________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学键的说法正确的是( )
A.构成单质分子的粒子中一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子中的化学键一定是极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的划“√”,错误的划“×”
(1)(2014·高考试题组合)
①施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效( )
(2014·新课标全国卷Ⅰ,8C)
②小苏打是面包发酵粉的主要成分之一( )
(2014·福建理综,6D)
③将NH4Cl溶液蒸干制备NH4Cl固体( )
(2014·福建理综,8B)
④NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中( )
(2014·天津理综,3B)
(2)(2013·高考试题组合)
①向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成( )
(2013·重庆理综,2C)
②饱和小苏打溶液中:c(Na+)=c(HCO )( )
)( )
(2013·广东理综,12B)
③室温下,对于0.1 mol·L-1氨水,用HNO3溶液完全中和后,溶液不显中性( )
(2013·福建理综,8C)
④已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO +H2O??H2SO3+OH-①
+H2O??H2SO3+OH-①
HSO ??H++SO
??H++SO ②
②
向0.1 mol·L-1的NaHSO3溶液中
a.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO )增大( )
)增大( )
(2013·安徽理综,13A)
b.加入少量NaOH溶液,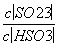 、
、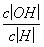 的值均增大( )
的值均增大( )
(2013·安徽理综,13C)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列关于电解质溶液的判断正确的是( )
A.在pH=12的溶液中,K+、Cl-、HCO 、Na+可以大量共存
、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO 、SO
、SO 、K+可以大量共存
、K+可以大量共存
C.由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液中存在BOH===B++OH-
D.由0.1 mol·L-1一元酸HA溶液的pH=3,可推知NaA溶液中存在A-+H2O??HA+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH )________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH )。
)。
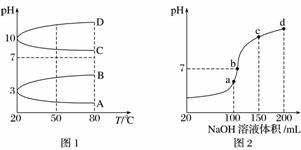
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填字母)。
②室温时,0.1 mol·L-1NH4Al(SO4)2中2c(SO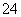 )-c(NH
)-c(NH )-3c(Al3+)=________mol·L-1(填数值)。
)-3c(Al3+)=________mol·L-1(填数值)。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示:
试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是________________________________。
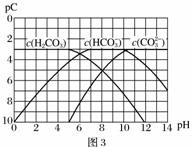
Ⅱ.pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg10-3=3。已知H2CO3溶液中存在下列平衡:CO2+H2O??H2CO3、H2CO3??H++HCO 、HCO
、HCO ??H++CO
??H++CO
图3为H2CO3、HCO 、CO
、CO 在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图。请回答下列问题:
在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图。请回答下列问题:
(1)在pH=9时,H2CO3溶液中浓度最大的含碳元素的离子为______。
(2)pH<4时,溶液中H2CO3的pC总是约等于3的原因是____________________。
(3)已知M2CO3为难溶物,则其Ksp的表达式为______;现欲将某溶液中的M+以碳酸盐(Ksp=1×10-12)的形式沉淀完全,则最后溶液中的CO 的pC最大值为______(溶液中的离子浓度小于1×10-5mol·L-1时,沉淀完全)。
的pC最大值为______(溶液中的离子浓度小于1×10-5mol·L-1时,沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
| A | B | C | D | |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H3PO4 | Ba(OH)2 |
| 非电解质 | C12H22O11 | |||
| (蔗糖) | BaSO4 | C2H5OH | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式为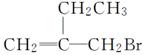 。下列关于该物质的说法中正确的是( )
。下列关于该物质的说法中正确的是( )
A.该物质可以发生水解反应
B.该物质能和AgNO3溶液反应产生AgBr沉淀
C.该物质可以发生消去反应
D.该物质分子中至多有4个碳原子共面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com