
【题目】现有以下物质①NaCl晶体②CO2③液态的纯醋酸④铜⑤BaSO4固体⑥蔗糖⑦酒精⑧氨水,请回答下列问题(填序号)
(1)能导电的是
(2)属于电解质的是
(3)属于非电解质的是 .
科目:高中化学 来源: 题型:
【题目】科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2﹣ . 下列叙述错误的是( )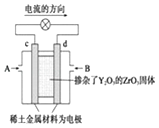
A.c电极是正极,发生还原反应
B.B口通入的是甲烷,发生氧化反应
C.放电时O2﹣离子向d极移动
D.d极上的电极反应式为:CH4+4O2﹣+8e﹣=CO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应SO2+O2=2SO3在密闭容器中进行。下列关于该反应的说法正确的是
A. 增大压强能减慢反应速率
B. v(SO2):v(O2)=2:1证明该反应已达到化学平衡状态
C. 当反应物和生成物浓度不变时,反应已达平衡
D. 增大02的浓度可使SO2完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火法炼铜的主要反应原理:Cu2S+O2=2Cu+SO2,下列说法正确的是
A. Cu是还原产物 B. SO2只是还原产物
C. 氧化剂只有O2 D. 1molS02生成转移4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究氨、乙醇的性质,某同学设计并进行了下列实验。
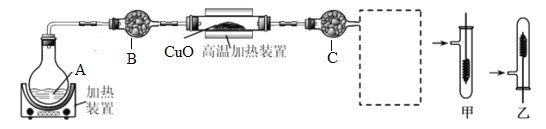
请回答:
(1)仪器B的名称为_____________。
(2)为快速制备氨气,A中应加入的试剂为______,B中应放入的试剂为_______。
(3)若A中加入乙醇,B中加入生石灰,C中加入无水硫酸铜,反应一段时间后,C中的现象为_________。经检测反应中既生成了乙醛,又生成了少量乙酸。请写出乙醇与氧化铜反应生成乙醛的化学方程式_____________________。
(4)在(3)中实验里,某同学为检验尾气中是否含有乙醇,虚线框处宜选择的装置是______(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入试管中,观察到铜丝由黑渐渐变红,由此可得出的结论是____________________。(并简述其理由)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有SO42﹣、CO32﹣、Cl﹣ . 为了检验其中是否含有SO42﹣ , 除BaCl2溶液外,还需要的溶液是( )
A.稀硫酸
B.稀盐酸
C.NaOH溶液
D.NaNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,一定条件下,它们之间有如下反应关系。A + B![]() C + D + E
C + D + E
(1)若A是碳,B是浓硫酸,C、D都是气体,试写出此反应的化学方程式_______________。
(2)若A是铜,B是硝酸,反应时生成的C是红棕色气体,反应的离子方程式是________________,生成的C与水反应的化学方程式为______________________________。
(3)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,试写出此反应的化学方程式____________________________________________;实验室检验C的方法__________________________________________________。
(4)若A是焙制糕点所用的发酵粉的主要成分,B是稀盐酸,则A和B在水溶液反应的离子方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素 X 位于 Y 的下一周期,X、Y 的原子序数均不大于 20。某含氧酸盐甲的化学式为 XYO3。请回答:
(1)常温下 Y 的单质能与水发生反应,则 X 在周期表中的位置_________________,X、Y 形成简单离子半径大小关系为 X_____________Y(填“大于”、“小于”或“等于”)。395℃时,甲能发生分解反应生成两种盐,一种是含 Y 元素的无氧酸盐,该反应的化学方程式是_____________________。
(2)若甲能与盐酸反应,生成无色、无味的气体乙。则:
①乙的电子式为_______________________。
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为___________________。
(3)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体。
① 则甲为_______(填化学式)。该气体能使高锰酸钾溶液褪色,该反应的离子方程式为________。
② 25℃时,甲在水中的沉淀溶解平衡曲线如下图所示,若要使溶液 X2+离子沉淀完全,则加入 YO32-离子的最小浓度为___________molL﹣1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
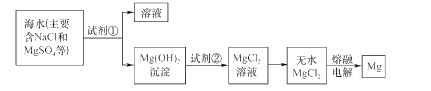
(1)为了使MgS04转化为Mg(OH)2,试剂①可以选用____(填化学式)。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是____。
(3)试剂②可以选用 ___(填化学式)。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com