
分析 A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,能相互反应生成沉淀的有:AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,现象为先生成白色沉淀,后沉淀溶解.BaCl2+FeSO4═BaSO4↓+2NaCl,现象为出现不溶于酸的白色沉淀.FeSO4+2NaOH═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3,特征现象为出现白色沉淀,立即变为红褐色.根据题意,①A+B→白色沉淀,加入稀硝酸,沉淀不溶解,该沉淀只能为BaSO4沉淀,因为Al(OH)3或Fe(OH)2都可溶于稀硝酸.②B+D→白色沉淀,在空气中放置,该沉淀由白色转为红褐色,说明白色沉淀为Fe(OH)2,红褐色沉淀为Fe(OH)3.则可确定B为FeSO4,A为BaCl2,D为NaOH.③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失,说明白色沉淀为Al(OH)3,C为AlCl3.以此来解答.
解答 解:(1)由上述分析可知,A、B、C、D分别为BaCl2、FeSO4、AlCl3、NaOH,故答案为:BaCl2;FeSO4;AlCl3;
(2)现象②中,B为FeSO4,D为NaOH,两者反应生成白色Fe(OH)2沉淀,该沉淀易被氧化生成红褐色Fe(OH)3沉淀.反应为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4 Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)现象③中,C为AlCl3,D为NaOH,两者反应生成Al(OH)3沉淀,Al(OH)3为两性氢氧化物可与NaOH继续反应,导致沉淀消失.反应为AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,改写离子方程式时,AlCl3、NaOH、NaCl、NaAlO2易溶于水易电离改成离子形式,Al(OH)3难溶于水难电离保留化学式,H2O是弱电解质保留化学式,删除相同离子,则离子方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查无机物的推断,为高频考点,把握离子之间的反应和现象推断物质为解答的关键,侧重分析与推断能力的考查,解题的突破口为特征反应和特征现象,注意元素化合物知识的应用,题目难度不大.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②使用催化剂,△H2减小 | |
| C. | 反应③中反应物的总能量高于生成物的总能量 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,砷属于p区元素.
,砷属于p区元素.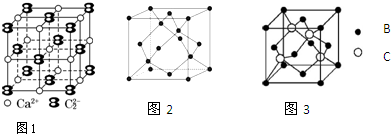
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
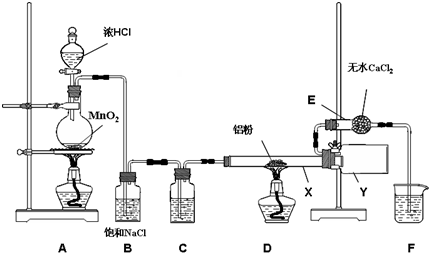
 2AlCl3
2AlCl3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{48}^{112}$Cd原子的中子数为64 | |
| B. | 聚氯化铝能降污是因为它有强氧化性 | |
| C. | 聚氯化铝是混合物 | |
| D. | 镉的单质有导电性和延展性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
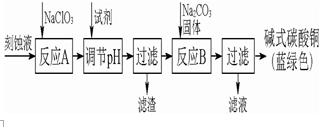 碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:
碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂与氧化产物的物质的量之比为5:8 | |
| B. | 若氧化产物比还原产物多1.4mol则转移电子为1mol | |
| C. | 每生成1.6mol氮气,则有0.2molKNO3被氧化 | |
| D. | NaN3属于硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 滤液A中阳离子为Fe2+、H+ | B. | 样品中金属Fe的质量为2.14g | ||
| C. | 样品中CuO的质量为4.0g | D. | V=448 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com