
氨气是一种重要的物质,可用于制取化肥和硝酸等.
(1)500°C、50Mpa时,在容积为VL的密闭容器中加入n mol N2、3n mol H2,经过t min后反应达到平衡后N2的转化率为a.则容器内气体的压强反应前与平衡时的比值为 ;t min内用NH3表示的速率是 ) mol/L.min
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g)+92.2kJ/mol
2NH3(g)+92.2kJ/mol
(表示当生成2mol NH3时放出92.2KJ的热).有关键能:N≡N:945.6kJ/mol;N﹣H:391.0kJ/mol,则H﹣H键能为 KJ/mol.
考点:
化学平衡的计算;有关反应热的计算;反应速率的定量表示方法.
专题:
化学反应中的能量变化;化学平衡专题.
分析:
(1)根据差量法计算出平衡时,反应混合物的总的物质的量,再根据压强之比等于物质的量之比计算;
根据v= 计算v(NH3).
计算v(NH3).
(2)反应热等于反应物的总键能减去生成物的总键能.
解答:
解:(1)、N2(g)+3H2(g) 2NH3(g) 物质的量减少△n
2NH3(g) 物质的量减少△n
1mol 3mol 2mol 2mol
namol 3namol 2namol 2namol
达平衡后,反应混合物的总的物质的量为nmol﹣namol+3nmol﹣3namol+2namol=2n(2﹣a)mol,
压强之比等于物质的量之比,所以容器内气体的压强反应前与平衡时的比值为 =
= ;
;
t min内,用NH3表示的速率v(NH3)= =2an/(V•t)mol/(L.min).
=2an/(V•t)mol/(L.min).
故答案为: ; 2an/(V•t)mol/(L.min).
; 2an/(V•t)mol/(L.min).
(2)反应热等于反应物的总键能减去生成物的总键能,令H﹣H键能为 xKJ/mol,则
945.6kJ/mol+3xKJ/mol﹣6×391.0kJ/mol=﹣92.2kJ/mol
解得,x=436.1
故答案为:436.1kJ/mol
点评:
考查化学平衡、反应热的计算,难度中等,加强基础知识的学习,(2)中反应热符号为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一配制一定浓度的醋酸溶液
(1)取冰醋酸配制250mL0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 .
实验二 探究浓度对醋酸电离程度的影响
测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol•L﹣1) | 0.0010 | 0.100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(2)表中数据是利用 (填仪器名称)测得的,根据表中数据,可以得出醋酸是 (填“强电解质”或“弱电解质”),你得出此结论的依据是
(3)已知10﹣2.73=1.86×10﹣3,利用此数据可以求得0.2000mol•L﹣1醋酸溶液的电离度α=
(4)用水稀释冰醋酸,电导率随加入水量的变化如右图所示A、B、C三点的电离度由大到小排列:
实验三 探究 对醋酸电离程度的影响
某同学利用传感器技术(如右下图),将20mL,0.1mol/L醋酸溶液放置在可加热磁力搅拌器上,并用pH传感器测量溶液的pH,利用电脑处理实验数据并作图(如下图)
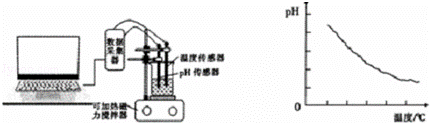
(5)由数据处理结果可以得到的结论是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
|
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
|
| B. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
|
| C. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
|
| D. | 氨气分子是极性分子而甲烷是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z分别位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述中不正确的是( )
|
| A. | WZ2分子中所有原子最外层都为8电子结构 |
|
| B. | WX2、ZX2的化学键类型相同 |
|
| C. | WX2是以极性键结合成的直线型分子 |
|
| D. | 原子半径大小顺序 W<X<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有如下两个反应:
A、2NaOH+H2SO4═Na2SO4+2H2O
B、CH4+2O2═CO2+2H2O
(1)根据反应的本质,两个反应都为 反应(放热或吸热),判断两个反应能否设计为原电池?(能或不能)
A B
(2)如果不能,说明其理由
(3)如果能,最好应选择 NaOH 电解质溶液(NaOH或H2SO4).则负极电极反应式: 正极电极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
丙酸、甲酸乙酯和乙酸甲酯三种有机物共同具有的性质是( )
|
| A. | 都能发生加成反应 | B. | 都能发生水解反应 |
|
| C. | 都能跟稀H2SO4反应 | D. | 都能跟NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法不正确的是( )
A.KClO3在反应中得到电子
B.ClO2是还原产物
C.H2C2O4在反应中被氧化
D.1molKClO3参加反应有2mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
将3.48 g四氧化三铁完全溶解在100 mL 1 mol·L-1硫酸中,然后加K2Cr2O7溶液25 mL,恰好使溶液中Fe2+全部转为Fe3+,Cr2O 全部转化为Cr3+,则K2Cr2O7溶液物质的量浓度是A.0.05 mol·L-1 B.0.1 mol·L-1 C.0.2 mol·L-1 D.0.3 mol·L-1
全部转化为Cr3+,则K2Cr2O7溶液物质的量浓度是A.0.05 mol·L-1 B.0.1 mol·L-1 C.0.2 mol·L-1 D.0.3 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com