
| A. | 112mL | B. | 224mL | C. | 118.72 mL | D. | 201.6 mL |
分析 根据Ksp[Mg(OH)2]=1.8×10-11计算开始有白色沉淀出现时,c(OH-),再根据氨水的电离平衡常数计算c(NH3.H2O),最后计算未电离前c(NH3.H2O),据此分析计算.
解答 解:向体积为1.0L、浓度为2.0×10-4 mol•L-1的MgCl2溶液中通入NH3,开始有白色沉淀出现时,c(OH-)=$\sqrt{\frac{1.8×10{\;}^{-11}}{2.0×10{\;}^{-4}}}$mol/L=3×l0-4mol/L,
结合氨水的电离平衡常数=$\frac{c(NH{\;}_{4}{\;}^{+})•c(OH{\;}^{-})}{c(NH{\;}_{3}•H{\;}_{2}O)}$=$\frac{c{\;}^{2}(OH{\;}^{-})}{c(NH{\;}_{3}•H{\;}_{2}O)}$=1.8×l0-5,所以c(NH3.H2O)=5×l0-3mol/L,
未电离前c(NH3.H2O)=5×l0-3mol/L+3×l0-4mol/L=5.3×l0-3mol/L,
n(NH3)=5.3×l0-3mol,
通入氨气的体积=5.3×l0-3mol/L×22.4L/mol=0.11872L=118.72mL,
故选:C.
点评 本题考查了溶度积及其电离平衡常数的计算等知识点,根据其公式来分析解答,难度中等.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
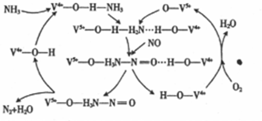

 | c(NH3)/mol•L-1 | c(O2)/mol•L-1 | c(NO)mol•L-1 |
| 0 | 1.2 | 1.75 | 0 |
| 4min | 0.4 | 0.75 | 0.8 |
| 6min | 0.4 | 0.75 | 0.8 |
| 8min | 0.6 | 1 | 0.6 |
| 9min | 0.6 | 1 | 0.6 |
| 10min | 1.05 | 1 | 1.05 |
| 12min | … | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中滴加Na2CO3溶液,立即产生沉淀和气体 | |
| B. | 若C(Cl-)=0.07mol/L,则溶液的PH为2 | |
| C. | 往溶液中加入NaOH溶液,先生成的沉淀呈红褐色 | |
| D. | 往溶液中通入NH3,直至溶液呈中性,此时溶液中C(NH4+)═C(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大 | |
| B. | 常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b | |
| C. | 若将适量CO2通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| D. | 常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4属于难溶物,它在水中完全不能溶解 | |
| B. | 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 | |
| C. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 | |
| D. | 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水俣病是由汞等重金属污染水体而造成的 | |
| B. | “赤潮”和“水华”是由水体富营养化而形成的 | |
| C. | 海湾战争期间波斯湾严重的石油泄漏事件是人类历史上一次灾难性的水体污染事件 | |
| D. | 化肥和农药的广泛使用可以促进农产品增产,不会造成水体污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com