
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 苯与氢气的反应: +3H2$→_{△}^{Ni}$ +3H2$→_{△}^{Ni}$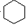 |
分析 A.溴乙烷不是电解质,无法用硝酸银溶液检验溴离子;
B.醋酸为弱酸,离子方程式中醋酸不能拆开;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.苯与氢气在Ni作催化剂条件下加热生成环己烷.
解答 解:A.溴乙烷为非电解质,溴乙烷中滴入AgNO3溶液没有明显现象,故A错误;
B.醋酸和碳酸钙都需要保留化学式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.利用腐蚀法制作印刷线路板,铁离子与铜反应生成亚铁离子和铜离子,正确的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.苯与氢气发生加成反应生成环己烷,反应的化学方程式为: +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$ ,故D正确;
,故D正确;
故选D.
点评 本题考查了化学方程式、离子方程式的书写判断,题目难度不大,明确书写原则为解答关键,A为易错点,注意溴乙烷不属于电解质,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | X 的能量一定高于M | |
| B. | Y 的能量一定高于N | |
| C. | X 和Y 的总能量一定高于M 和N 的总能量 | |
| D. | 因该反应为放热反应,故不必加热就可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
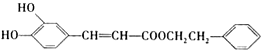 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化:
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
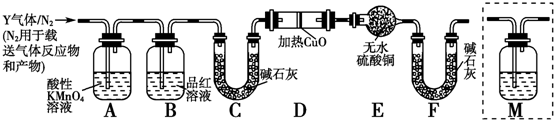
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇中含有的氧原子数目为NA | |
| B. | 6.4g的S2和S8混合物中,含硫原子总数为0.2NA | |
| C. | 0.1 mol•L-1的NaHSO4溶液中含有阳离子的总数为0.2NA | |
| D. | 7.8 g Na2O2与水反应,转移的电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com