
| A.原子半径大小顺序,Na>Mg>S>Cl |
| B.S02和Na2O2都能使品红溶液褪色,他们的漂白原理相同 |
| C.酸性:HCLO4>H2S04 |
| D.Na2SO3在空气中长期放置容易变质 |
科目:高中化学 来源: 题型:
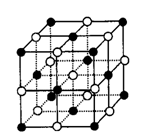 KO2的晶体结构(如图)与NaCl相似,可以看作是Na+的位置用K+代替,Cl-的位置用O-2代替,下列关于KO2的组成和结构的分析中正确的是( )
KO2的晶体结构(如图)与NaCl相似,可以看作是Na+的位置用K+代替,Cl-的位置用O-2代替,下列关于KO2的组成和结构的分析中正确的是( )
A.KO2中既有离子键,又有极性键![]()
![]()
![]() w_w w. k#s5_u.c o*m
w_w w. k#s5_u.c o*m
B.1 mol KO2中含有的离子数目为3×6.02×1023
C.该晶体在熔融状态下能导电
D.和K+距离相同且最近O-2的共有12个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com