
����Ŀ����ҵ�кܶ���Ҫ�Ļ���ԭ�϶���Դ��ʯ�ͻ�������ͼ�еı�����ϩ���л���A�ȣ�����A�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ����ش��������⣺
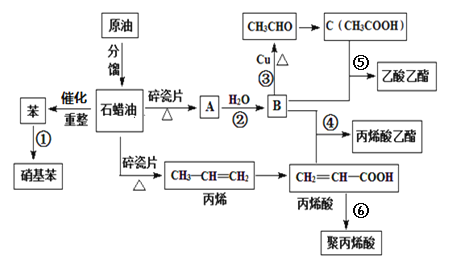
��1����ϩ���к��������ŵ�����Ϊ___��
��2��д�����з�Ӧ�ķ�Ӧ���͢�___����___��
��3������˵����ȷ������__________��
A.�������л���ŨHNO3��H2SO4�����䵹�뵽NaOH��Һ�У����ã���Һ
B.��ȥ���������е����ᣬ��NaOH��Һ����Һ
C.�۱�ϩ���ܹ�ʹ���Ը��������Һ��ɫ
D.�л���C���ϩ������ͬϵ��
��4��д�����з�Ӧ����ʽ��
��B��CH3CHO___��
�ܱ�ϩ��+B����ϩ������___��
���𰸡��Ȼ� ������Ӧ��ȡ����Ӧ �Ӿ۷�Ӧ A 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH2=CHCOOH + CH3CH2OH
2CH3CHO+2H2O CH2=CHCOOH + CH3CH2OH![]() CH2=CHCOOCH2CH3+ H2O
CH2=CHCOOCH2CH3+ H2O
��������
A�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ����AΪ��ϩ��A��ˮ��Ӧ�����Ҵ����Ҵ������ᷢ��������Ӧ�õ������������Ҵ�����������ȩ����BΪ�Ҵ���������̽��
(1)��ϩ���к��������ŵ�����Ϊ�Ȼ����ʴ�Ϊ���Ȼ���
(2)��Ӧ�ݣ�������Ҵ�����������Ӧ������������������Ӧ����ȡ����Ӧ����Ӧ�ޣ���ϩ�ᷢ���Ӿ۷�Ӧ���ɾ۱�ϩ�ᣬ�ʴ�Ϊ��������Ӧ��ȡ����Ӧ���Ӿ۷�Ӧ��
(3)A���������л���ŨHNO3��H2SO4�����䵹�뵽NaOH��Һ�У�����������NaOH��Ӧ��HNO3��H2SO4��NaOH��Ӧ����ˮ�㣬������������ˮ�����ú�ֲ㣬ͨ����Һ��ȥˮ�㣬�Ӷ���ȥ�������л��е�ŨHNO3��H2SO4��A��ȷ��
B�����������ܺ�NaOH��Ӧ��B����
C����ϼӾ۷�Ӧ��ԭ����֪�۱�ϩ��ṹ��ʽΪ![]() �����ܹ�ʹ���Ը��������Һ��ɫ��C����
�����ܹ�ʹ���Ը��������Һ��ɫ��C����
D����ϩ��(CH2=CHCOOH)�к�̼̼˫�����л���C(CH3COOH)����̼̼˫�������߽ṹ�����ƣ�����Ϊͬϵ�D����
�ʴ�ѡA��
(4)��Ӧ�ۣ�B��CH3CHOΪ�Ҵ��Ĵ���������Ӧ�Ļ�ѧ����ʽΪ2CH3CH2OH+O2![]() 2CH3CHO+2H2O���ʴ�Ϊ��2CH3CH2OH+O2
2CH3CHO+2H2O���ʴ�Ϊ��2CH3CH2OH+O2![]() 2CH3CHO+2H2O��
2CH3CHO+2H2O��
��Ӧ�ܣ���ϩ��+ B����ϩ������+ H2OΪ������Ӧ����Ӧ�Ļ�ѧ����ʽΪCH2=CHCOOH + CH3CH2OH![]() CH2=CHCOOCH2CH3+ H2O���ʴ�Ϊ��CH2=CHCOOH + CH3CH2OH
CH2=CHCOOCH2CH3+ H2O���ʴ�Ϊ��CH2=CHCOOH + CH3CH2OH![]() CH2=CHCOOCH2CH3+ H2O��
CH2=CHCOOCH2CH3+ H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��Ϊ�ⶨ�����Ѿõ�С�մ���Ʒ�д���������������������ʵ�鷽����
��1������һ����ȡһ����������Ʒ�����������м��������غ���ȴ����ȡʣ��������������㡣
����ɱ�ʵ����Ҫ�����ò��������裬��Ŀ����_______________________________��
����ʵ��ǰ������Ʒ������Ϊm g������������ʱ��������Ϊa g������Ʒ�д������������Ϊ________��
��2��������������ͼ��ʾװ�ý���ʵ�飬���ش��������⣺
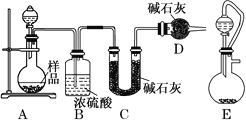
��ʵ��ǰ�ȼ��װ�õ������ԣ�����ȡһ����������Ʒ����A�У���ϡ����װ���Һ©���С�Dװ�õ�������________________��
��ʵ���г�������Ʒ�����⣬����ֱ����_______װ�÷�Ӧǰ��������(��װ����ĸ����)��
�۸��ݴ�ʵ��õ������ݣ��ⶨ���������Ϊʵ��װ�û�����һ�����Ե�ȱ�ݣ���ȱ����_________��
����ͬѧ��Ϊ����Eװ�����Aװ�������ʵ��ȷ�ȡ�����Ϊ�Ƿ���ȷ��_________(��ǡ���)��
��3������������ȡһ��������Ʒ������ƿ�У�������ˮ����������еζ����ӿ�ʼ����������������岻�ٲ��������μӵ����������ͼ��ʾ����С�մ���Ʒ�д������������Ϊ_________(������λ��Ч����)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ��̼���������������ס���������Ԫ������ͭԪ���ڻ�ѧ���к���Ҫ�ĵ�λ���ش��������⣺
(1)�ڻ�̬14Cԭ����,�������___�������෴�ĵ��ӣ���̬��ԭ�ӵļ۲�����Ų�ͼΪ____��
(2)��F2ͨ��ϡNaOH��Һ�п�����OF2,OF2���ӹ���Ϊ__������ԭ�ӵ��ӻ���ʽΪ_______��
(3)CuSO4��Һ������P4�ж��Ľⶾ��,��Ӧ������P����ۺ������ͭ,�÷�Ӧ�Ļ�ѧ����ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯���������������о�����Ҫ�����á�
(1)�����ڻ��ý���ȴ���ڿ������ȶ����ڣ�ԭ����(�û�ѧ���P�������˵��)___��
(2)�����������Խ�����ִ��������������й㷺��Ӧ�á���������������价������ȫ���ܵ�Խ��Խ��Ĺ�ע����ԭ����ͼ��ʾ��
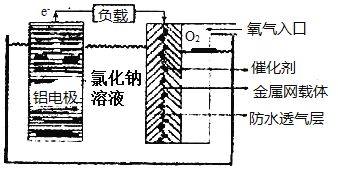
�õ�ص�������Ӧ����ʽΪ___�������缫��������9�ˣ�����һ��ͨ�������������ڱ�״����Ϊ___��
(3)AlCl3��NaN3�ڸ����·�Ӧ���Ƶø��½ṹ�մɵ�����(AlN)��������N2��д����Ӧ��ѧ����ʽΪ___��
(4)��Ԫ�����ڱ��У���λ��������һ���ڣ��뵪Ԫ��ͬ���壬д��AsH3���ӵĵ���ʽΪ___����ͬѹǿ�£�AsH3�ķе�___NH3(��������������С����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п���仯������;�㷺���ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ͼΪ___________��
��2����֪��̬п��ͭ�ĵ����������ʾ��
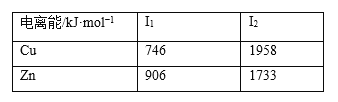
�ɱ�������֪��I2(Cu)��I2(Zn)��ԭ����__________��
��3��H2O�����еļ�����H2S�еļ���______����������������������H2O���ӵļ��DZ�H2S�ļ��Ǵ���ԭ����_______��
��4��S8���ȵ�ŨNaOH��Һ��Ӧ�IJ���֮һΪNa2S3,S32-�Ŀռ乹��Ϊ_________��
��5����ԣ�![]() ���㷺Ӧ���ںϳ�ҽҩ��ũҩ��Ⱦ�Ϲ�ҵ��
���㷺Ӧ���ںϳ�ҽҩ��ũҩ��Ⱦ�Ϲ�ҵ��
����Է����еĴ��������÷���![]() ��ʾ������m���������γɴ�������ԭ������n���������γɴ������ĵ��������籽�����еĴ������ɱ�ʾΪ
��ʾ������m���������γɴ�������ԭ������n���������γɴ������ĵ��������籽�����еĴ������ɱ�ʾΪ![]() ��������Է����еĴ�����Ӧ��ʾΪ______��
��������Է����еĴ�����Ӧ��ʾΪ______��
����Եķе�Ϊ84 �棬������![]() ���ķе���129��131 ��֮�䣬���߷е�ϸߣ���ԭ����___��1 mol������____mol ������
���ķе���129��131 ��֮�䣬���߷е�ϸߣ���ԭ����___��1 mol������____mol ������
��6����п��һ�ְ뵼����ϣ��侧���ṹ��ͼ��ʾ��
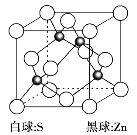
��֪����п�����ܶ�Ϊd g��cm3��NA���������ӵ�������ֵ����Zn2��S2֮�����̺˼�ࣨx��Ϊ_________nm���ô���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���ˮ�������������ֱ������ȼ�ϵ�ء��ش��������⣺
(1)��֪�״��ֽⷴӦ��CH3OH(g)![]() CO(g)��2H2(g) ��H1����90.64 kJ��mol��1��
CO(g)��2H2(g) ��H1����90.64 kJ��mol��1��
ˮ�����任��Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H2����41.20 kJ��mol��1��
CO2(g)��H2(g) ��H2����41.20 kJ��mol��1��
��CH3OH(g)��H2O(g)![]() CO2(g)��3H2(g) ��H3��___________kJ��mol��1��
CO2(g)��3H2(g) ��H3��___________kJ��mol��1��
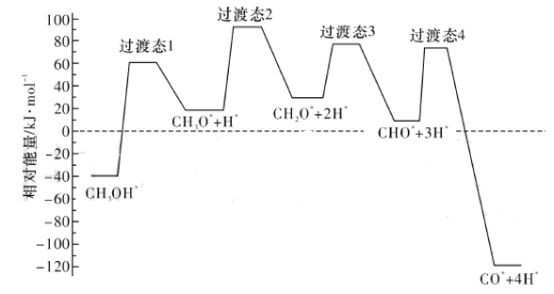
(2)��ѧ��ͨ���ܶȷ��������о��״���ˮ�����������ⷴӦ����ʱ���õ��״���Pd(III)���淢������ʱ�ĸ�·������������Ĺ�ϵ��ͼ��ʾ�����и���Pd(III)�����������*��ע���������л����С�ķ�Ӧ����ʽΪ_____________________________________________��
(3)��0.1MPa�£����ܽ�����Ϊ1 mol��n(CH3OH)��n(H2O)��1��1.3�Ļ���������һ�����ܱ������з�Ӧ��
��ʵ����ˮ�����任��Ӧ���������¶ȵ����������½���ԭ����____________________��
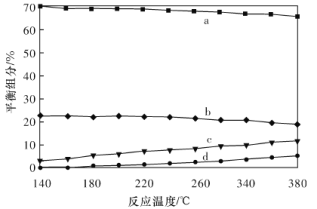
��ƽ��ʱ�����CH3OH�ĺ����ڸ����¶ȷ�Χ�ڼ�С��H2��H2O(g)��CO��CO2������ֵĺ����뷴Ӧ�¶ȵĹ�ϵ��ͼ��ʾ������b��c��Ӧ���ʵĻ�ѧʽ�ֱ�Ϊ________��________��
(4)573.2Kʱ����һ�����ܱ������г���5.00 MPa CH3OHʹ��ֽ⣬t h���ƽ��ʱH2�����ʵ�������Ϊ60%����t h��v(CH3OH)��_____MPa��h��1�����ѹƽ�ⳣ��Kp��_____MPa2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ŵ���ұ����������ɾ���������ش�
(1)�̴�˾ĸ�춦����_____(ѡ������ͭ���������Ͻ����������Ͻ���)��Ʒ��
(2)��ͼΪͭ���仯����֮���ת����ϵ(��Ӧ������ȥ)��
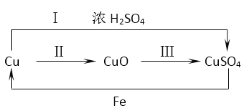
������ת����������ɫ�ı仯���Ϻ�ɫ��ͭ��������Ӧ����______ɫ������ͭ��
�������������Ϊͭ���������ҹ��Ŵ�ʪ����ͭ��ԭ�������еķ�Ӧ�У�Fe + CuSO4 = FeSO4 + Cu���ɴ˿�֪����ͭ�Ľ������________(ѡ��д��ǿ����������)��
��Ϊ��֤ͭ��Ũ���ᷴӦ���ɵ����壬������ͨ��Ʒ����Һ���۲쵽��������_______��
������ͼ��֪���Ʊ�����ͭ������;����(��Ӧ��)��;����(��Ӧ��+��),�ӻ����Ƕȿ��ǣ�Ӧѡ��;��________(ѡ����������������)��������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A����ϵͳ��������������![]() ������Ϊ2������3��4�����һ�����
������Ϊ2������3��4�����һ�����
B���������ļ��顢�Ҵ�����ȩ�ֱ���ȼ�գ������������������μ�С
C���������ʵķе㰴�ɵ͵���˳��Ϊ����CH3��2CHCH3����CH3��4C����CH3��2CHCH2CH3��CH3��CH2��3CH3
D��![]() ��
��![]() ��Ϊͬϵ��
��Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���뵼����CO2������ͼ����ʾ����Ƴ��绯ѧװ����ͼ����ʾ��������˵����ȷ���ǣ� ��
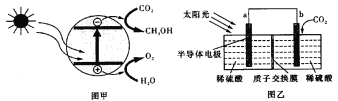
A.����������4mol�����ƶ��������ӽ���Ĥ������22.4 L O2
B.װ���н��е��ܷ�Ӧһ�����Է���������ԭ��Ӧ
C.b���ϵĵ缫��ӦΪ��CO2��6H����6e��=CH3OH��H2O
D.ͼ���е�����ת����ʽΪ����������������ѧ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com