
| 3 |
| 2 |
| 3 |
| 2 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| A | B | C | D | |
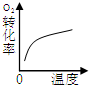
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加O2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |
 |
 |
 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| c2(NO2) |
| c2(NO)?c(O2) |
| 0.01-0.004 |
| 2 |
| 1 |
| 2 |
| c2(NO2) |
| c2(NO)?c(O2) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1 mol过氧化钠中阴离子所带的负电荷数为NA |
| B、14 g乙烯和丙烯的混合物中含有的碳原子的数目为NA |
| C、28 g C16O与28 g C18O中含有的质子数均为14 NA |
| D、标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 挤压装置的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹 |
B、 挤压装置的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹 |
C、 用鼓气装置从装置的a处不断鼓入空气并打开止水夹 |
D、 向装置的水槽中慢慢加入足量浓硫酸并打开止水夹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,5.6 L一氧化氮和5.6L氧气混合后的分子总数为0.5NA |
| B、在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 |
| C、1 mol乙烷分子中含有8NA个共价键 |
| D、58.5 g的氯化钠固体中含有NA个氯化钠分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com