
【题目】上海某一超市销售的某种食用精制盐包装袋上有如下说明:

(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式并画出电子转移的方向与数目:_____KIO3+_____KI+_____H2SO4=_____K2SO4+_____I2+_____H2O;电子转移情况如下(双线桥表示)__________________________________;
(2)上述反应生成的I2可用叫氯化碳萃取,并用分液漏斗分离出两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL CCL4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞上的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗方正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.静置,分层。
a、正确的操作顺序是(用编号字母填写)_____→_____→_____→A→_____→_____E→F。
b、下列物质。还能用作从溶液中萃取碘的溶剂是_____。
A.苯 B.碘化钾 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。Na2SO3稀溶液与I2反应的主要产物(化学式)是_____。
(4)已知:I2+2Na2S2O3=2NaI+Na2S4O6.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液15.00mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_____。
②根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_____mg/kg。
【答案】1 5 3 3 3 3  C B D G H A Na2SO4、HI 溶液由蓝色恰好变为无色
C B D G H A Na2SO4、HI 溶液由蓝色恰好变为无色 ![]()
【解析】
(1)反应中KIO3与KI之间发生氧化还原反应生成I2,根据氧化剂、还原剂之间得失电子数目相等可知KIO3~5KI,结合原子守恒配平化学方程式;其中KIO3为氧化剂,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,化合价升高值=化合价降低值=转移电子数=5,据此分析电子转移情况;
(2)a、CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液,据此分析正确的操作步骤;
b、碘易溶于有机溶剂,且有机溶剂不溶于水,与水不反应,据此进行分析;
(3)亚硫酸根子与碘单质发生氧化还原反应生成硫酸钠、碘化氢,据此写出离子方程式;
(4)①由于碘遇淀粉显蓝色,据此性质进行滴定终点的判断;
②根据(1)中的反应式可知,KIO3~3I2~6Na2S2O3,所以碘酸钾的物质的量是2.0×10-5mol×1/6,根据m=![]() 计算出精制盐的碘含量,注意单位变换。
计算出精制盐的碘含量,注意单位变换。
(1)反应中KIO3与KI之间发生氧化还原反应生成I2,根据氧化剂、还原剂之间得失电子数目相等可知KIO3~5KI,结合原子守恒配平书写可得化学方程式为:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O,其中KIO3为氧化剂,I元素的化合价由+5价降低为0,I元素的化合价由﹣1价升高为0,化合价升高值=化合价降低值=转移电子数=5,电子转移情况如下: ;
;
故答案为:1、5、3、3、3、3; ;
;
(2)a、CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液,则步骤为C→B→D→A→G→H→E→F;
故答案为:C;B;D;G;H;
b、选用苯从碘水中萃取碘,苯与水不互溶,而且碘在苯中的溶解度比在水中的大得多,碘化钾溶液和酒精和水溶液混溶不能分层,故选A,
(3)亚硫酸根子与碘单质发生氧化还原反应生成硫酸钠、碘化氢,离子方程式:Na2SO3+I2+H2O=Na2SO4+2HI,Na2SO3稀溶液与I2反应的主要产物是Na2SO4、HI;
(4)①由于碘遇淀粉显蓝色,所以判断c中反应恰好完全时依据的现象是溶液由蓝色恰好变为无色;
②根据(1)中的反应式可知,KIO3~3I2~6Na2S2O3,所以碘酸钾的物质的量是2.0×10-5mol×![]() ,因此所测精制盐的碘含量是
,因此所测精制盐的碘含量是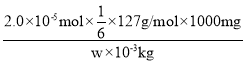 =
=![]() mg/kg。
mg/kg。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)![]() 4C(g)+D(g)ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。下列说法正确的是
4C(g)+D(g)ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。下列说法正确的是

A. 当温度升高后,则图中θ>45°
B. 若再加入B,再次达到平衡状态时,正、逆反应速率均增大
C. 平衡时B的转化率为50%
D. 若再加入B,则平衡后反应体系气体密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示![]() 、
、![]() 装置电解氯化铜溶液和饱和食盐水。下列判断错误的是( )
装置电解氯化铜溶液和饱和食盐水。下列判断错误的是( )

A. 阳极失电子的离子相同、产物相同
B. 阴极产物因得电子的离子不同而不同
C. 电解后两装置中溶液的pH都减小
D. 电解后只有![]() 装置阴极的质量增加
装置阴极的质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点是390℃,沸点是430℃,溶于冷水,遇热水则强烈水解。在380~400℃时锂与氨气直接反应可制得LiNH2,下面是实验室制备LiNH2时可能用到的装置图,回答下列问题。

(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是___________(填宇母)。
A.浓氨水、CaO B.NH4Cl固体、Ca(OH)2固体
C.浓氨水 D.NH4NO3固体、NaOH固体
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为___________(填接口处宇母),装置A的作用是______________________。
(3)装置C中仪器的名称是___________,盛装的试剂是___________。实验开始后,向X中通入NH3与加热仪器X的先后顺序为___________。
(4)实验室还可用浓氨水与固体NaOH混合制备氨气,但多次实验表明,此方法收集到的NH3量总是比理论值低许多,其最可能的原因是______________________。
(5)氨基锂能与热水反应生成LiOH与一种气体,请推测该气体的成分并用实验验证你的结论:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①5.2g的气态乙炔(C2H2)在氧气中燃烧,生成二氧化碳和液态水,放出260kJ的热量,其热化学方程式为:___________________________________________________________。又知H2O(l)==H2O(g)△H= +44kJ/mol,则11.2L(标准状况)乙炔完全燃烧生成气态水时放出的热量是_________kJ。
②已知:CH4 的燃烧热为890 kJ/mol,H2的热值为142.5kJg-1,现有标准状况下22.4 L CH4和H2的混合气体完全燃烧时,放出的热量为527kJ,求混合气体中CH4 和H2的体积比_____________
③将1mol NO2投入到1L容器中进行 2NO2(g)![]() N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弾的工作电源。一种热激活电池的基本结钩如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb,下列有关说法正确的是( )

A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极
B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移
C. 每转0.2mol电子,论上消耗42.5gLiCl
D. 电池总反应为Ca+PbSO4+2LiCl=Pb+Li2SO4+CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是由X和Y两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如右图所示的转化关系。下列说法不正确的是

A. X、Y、Z三种元素能组成离子化合物
B. 反应②为化合反应,反应③为置换反应
C. 常温常压下,Z的简单氢化物的熔沸点为同族最高
D. 原子半径:Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.46g N2O4气体中含有的原子数为3NA
B.标准状况下,22.4L SO3中含有SO3分子数为NA
C.50mL 12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D.用电解法精炼铜的反应中转移0.2NA个电子时,阳极溶解6.4g铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。请回答下列问题:
(1)铁元素基态原子的电子排布式为_________,3d能级上的未成对电子数为_________,能量最高能级的电子云形状为_________。
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为_________,写出一个与SCN-具有相同空间构型的分子:_________。
(3)氮元素的最简单氢化物为氨,氨的沸点_________(填“高于”或“低于”)膦(PH3),原因是_________。氮元素另一种氢化物联氨(N2H4)是_________(填“极性”或“非极性”)分子,其中心原子的轨道杂化类型为_________。
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是_________。
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:_________。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是_________g/cm3(设阿伏加德罗常数的值为NA)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com