
【题目】三氯化磷![]() 是一种重要的有机合成催化剂。实验室常用红磷与干燥的
是一种重要的有机合成催化剂。实验室常用红磷与干燥的![]() 制取
制取![]() ,装置如图所示。
,装置如图所示。
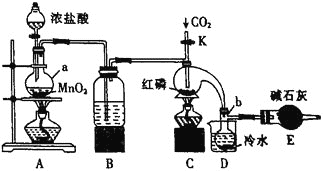
已知:![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() ,易被氧化,遇水易水解,与
,易被氧化,遇水易水解,与![]() 反应生成
反应生成![]() 。
。
请回答下列问题:
(1)装置A中发生反应的化学方程式为___________。
(2)仪器b的名称是___________,装置B中所装试剂名称是___________,装置E中碱石灰的作用是___________。
(3)实验时,检查装置气密性后,向装置C的曲颈瓶中加入红磷,打开止水夹K通入干燥的![]() ,一段时间后,关闭K,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通入干燥
,一段时间后,关闭K,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通入干燥![]() 的作用是___________。
的作用是___________。![]() 不能用
不能用![]() 代替,理由是___________。
代替,理由是___________。
(4)装置D的作用是___________。
(5)![]() 水解得到亚磷酸
水解得到亚磷酸![]() ,二元弱酸
,二元弱酸![]() ,写出亚磷酸钠被浓硝酸氧化的离子方程式:___________。
,写出亚磷酸钠被浓硝酸氧化的离子方程式:___________。
(6)经分析,![]() 产品中含有少量
产品中含有少量![]() ,某同学设计如下实验测定
,某同学设计如下实验测定![]() 的纯度:取
的纯度:取![]() 产品于锥形瓶中,加入过量稀硝酸,振荡充分反应,然后加入足量的硝酸银溶液,完全反应后过滤,滤渣经干燥后称量得
产品于锥形瓶中,加入过量稀硝酸,振荡充分反应,然后加入足量的硝酸银溶液,完全反应后过滤,滤渣经干燥后称量得![]() 。则该产品中
。则该产品中![]() 的质量分数为___________
的质量分数为___________![]() 保留两位有效数字
保留两位有效数字![]() 。
。
【答案】4HCl+MnO2![]() 2H2O+MnCl2+Cl2↑ 蒸馏烧瓶 浓硫酸 吸收
2H2O+MnCl2+Cl2↑ 蒸馏烧瓶 浓硫酸 吸收![]() 、HCl,防止污染空气,同时防止空气中的水蒸气进入装置D中而使
、HCl,防止污染空气,同时防止空气中的水蒸气进入装置D中而使![]() 水解 排除装置C、D中的氧气和水蒸气 防止
水解 排除装置C、D中的氧气和水蒸气 防止![]() 过量生成
过量生成![]() 冷凝收集
冷凝收集![]()
![]()
![]()
【解析】
实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5C,利用D装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用E装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应;
(1)A装置中二氧化锰和浓盐酸反应制取氯气,结合电子守恒和原子守恒写出发生反应的化学方程式;
(2)氯气为酸性气体,需用酸性干燥剂干燥,含有氯气的尾气对环境有污染,碱石灰能吸收酸性气体和水蒸气,D中收集的PCl3易水解;
(3)防止PCl3与O2等发生副反应,通入二氧化碳赶净空气,另外PCl3能与Cl2反应生成PCl5,;
(4)三氯化磷沸点低,可用冷水冷凝收集;
(5)亚磷酸钠遇浓硝酸应被氧化为H3PO4(中强酸),同时硝酸被还原为NO2,结合电子守恒、电荷守恒和原子守恒写出发生反应的离子方程式;
(6)利用氯原子守恒列方程计算![]() 的量,再计算
的量,再计算![]() 的百分含量。
的百分含量。
(1)装置A是制备氯气的装置,发生反应的化学方程式为:4HCl+MnO2![]() 2H2O+MnCl2+Cl2↑;
2H2O+MnCl2+Cl2↑;
(2)仪器b的名称是蒸馏烧瓶;装置B是干燥装置,吸收氯气中的水蒸气,盛装的应为浓硫酸;由已知信息可知![]() 遇水易水解,则装置E中碱石灰的作用一方面是防止空气中的水蒸气进入;另一方面氯气和HCl不能与红磷完全反应,则碱石灰还可以吸收
遇水易水解,则装置E中碱石灰的作用一方面是防止空气中的水蒸气进入;另一方面氯气和HCl不能与红磷完全反应,则碱石灰还可以吸收![]() 、HCl,防止污染空气;
、HCl,防止污染空气;
(3)通入干燥![]() 的作用是排除装置C、D中的氧气和水蒸气,防止影响P和氯气的反应; 已知
的作用是排除装置C、D中的氧气和水蒸气,防止影响P和氯气的反应; 已知![]() 与
与![]() 反应生成
反应生成![]() ,则
,则![]() 不能用
不能用![]() 代替,否则装置内氯气过量可能生成
代替,否则装置内氯气过量可能生成![]() ;
;
(4)已知:![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() ,则装置D冷水浴的作用是冷凝收集
,则装置D冷水浴的作用是冷凝收集![]() ;
;
(5)亚磷酸钠被浓硝酸氧化生成磷酸,浓硝酸被还原为![]() ,反应的离子方程式为:
,反应的离子方程式为:![]() ;
;
(6)![]() 的物质的量为:
的物质的量为:![]() ;说明
;说明![]() 产品中含有的氯元素的总物质的量为
产品中含有的氯元素的总物质的量为![]() ,设其中有xmol
,设其中有xmol ![]() 和
和![]() ,列方程组:
,列方程组:
![]() ,解得:
,解得:![]() ,则
,则![]() ,则
,则![]() 的质量分数为
的质量分数为![]() 。
。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,已知PdI2在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
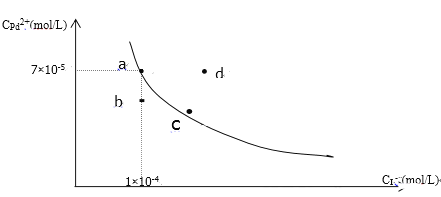
A. 在t℃时PdI2的Ksp=7.0×10-9
B. 图中a点是饱和溶液,b、d两点对应的溶液都是不饱和溶液
C. 向a点的溶液中加入少量NaI固体,溶液由a点向c点方向移动
D. 要使d点移动到b点可以降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
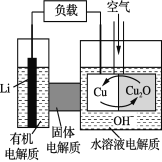
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知ClCH=CHCl 有两种结构:![]() 和
和![]() ,像这种由于双键不能自由旋转形成的异构体,叫顺反异构体,下列烯烃存在顺反异构现象的是
,像这种由于双键不能自由旋转形成的异构体,叫顺反异构体,下列烯烃存在顺反异构现象的是
A.CH2=CH2B.CH3CH=CH2
C.CH3CH=CHCH3D.CH3CH=C(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家运用穿山甲的鳞片特征,制作出具有自我恢复性的防弹衣,具有如此神奇功能的是聚对苯二甲酰对苯二胺(G)。其合成路线如下:
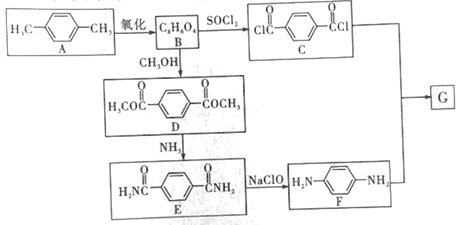
回答下列问题:
(1)A的化学名称为___。
(2)B中含有的官能团名称为___,B→C的反应类型为___。
(3)B→D的化学反应方程式为___。
(4)G的结构简式为___。
(5)芳香化合物H是B的同分异构体,符合下列条件的H的结构共有___种(不考虑立体异构),其中核磁共振氢谱有四组峰的结构简式为___。
①能与NaHCO3溶液反应产生CO2;②能发生银镜反应
(6)参照上述合成路线,设计以![]() 为原料(其他试剂任选),制备
为原料(其他试剂任选),制备![]() 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素类化合物常用于治疗血栓性疾病,由 4-羟基香豆素(X)和苯代亚苄基丙酮(Y)反应可得到苯代苄丙酮香豆素(Z)。
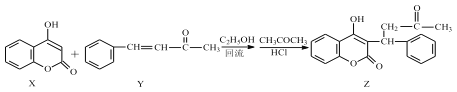
下列说法正确的是
A.X、Y 生成 Z 的反应为加成反应
B.Z 分子中所有碳原子可能共平面
C.1mol 化合物 X 最多能与 1mol NaOH 反应
D.1 mol 化合物 Y 最多能与 5 mol H2 发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子化合物 F 的合成路线如下:
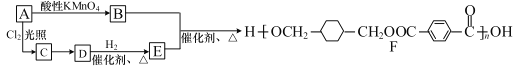
(1)A 的分子式为 C8H10,则 A、E 的结构简式分别是_________、_________。
(2)A→B 的反应类型是_________。
(3)写出 C→D 的反应方程式:_________ 。
(4)H 是 E 的一种同分异构体,其分子中含有 3 种不同化学环境的氢,能使溴水褪色,1mol 该分子最多与 2 mol Na 反应,写出符合条件的 H 结构简式_________任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeCl3溶液呈_______性,原因是__________(用离子方程式表示)。把FeCl3溶液蒸干后并灼烧,最后得到的主要固体产物是_________。
(2)在25℃下,将a mol·L-1的CH3COOH与0.01 mol·L-1的NaOH等体积混合,反应平衡时溶液中c(CH3COO-)=c(Na+),则溶液显______ (填“酸”、“碱”或“中”)性;用含a的代数式表示CH3COOH的电离常数Ka=__________ 。
(3)已知298 K和101 kPa条件下:
N2(g)+3H2(g)=2NH3(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l) ΔH4
则N2H4(l)的标准燃烧热ΔH=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com