
如题图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
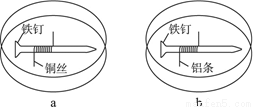
A. a中铁钉附近呈现红色 B. b中铁钉上发生还原反应
C. a中铜丝上发生氧化反应 D. b中铝条附近有气泡产生
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源:2017届山东省青岛市高三第一次统一质量检测理综化学试卷(解析版) 题型:填空题
用含钴废料(主要成分为Co,含有一定量的Ni、Al203、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的工业流程如图。己知:①草酸钴晶体难溶于水②RH为有机物(难电离)
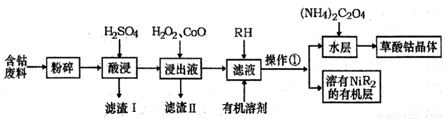
(1)滤渣I的主要成分是______(填化学式),写出一种能提高酸浸速率的措施_______。
(2)操作① 用到的主要仪器有________________。
(3)H2O2是一种绿色氧化剂,写出加入H2O2后发生反应的离子方程式__________。
(4)加入氧化钴的目的是__________。
(5)草酸钴晶体分解后可以得到多种钴的氧化物(其中Co的化合价为+2、+3),取一定量钴的氧化物,用280mL 5mol/L盐酸恰好完全溶解,并得到CoCl2溶液和2.24L(标准状况)黄绿色气体,由此可确定该钴氧化物中Co、O的物质的量之比为_________。
(6)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-),测定溶液中C2O42-的浓度,写出此反应的离子方程式_________;KMnO4 标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市宝应县高二下学期学业水平测试(三)化学试卷(解析版) 题型:选择题
下列实验装置、试剂选用或操作正确的是
A. 除去CO2中的HCl 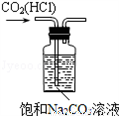
B. 干燥Cl2 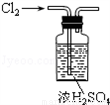
C. 稀释浓硫酸 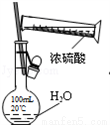
D. 制备少量O2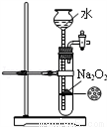
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:选择题
在25℃时,用0.125mol•L-1的标准盐酸滴定25.00mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为( )
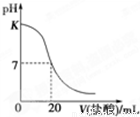
A. 11 B. 12 C. 13 D. 11
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:选择题
在一定温度下,一定量的水中石灰乳悬浊液存在下列平衡:
Ca(OH)2(s)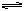 Ca2+(aq)+2OH-(aq)
Ca2+(aq)+2OH-(aq)
当向浑浊液中加入少量的生石灰,又恢复到原温度时,下列说法中正确的是( )
A. 溶液中Ca2+数不变 B. c(Ca2+)增大
C. pH不变 D. pH增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:选择题
已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是( )
A. N2H4+O2=N2+2H2O△H= —534.4kJ/mol
B. N2H4(g)+ O2(g)=N2(g)+2H2O(g)△H= —16.7kJ/mol
C. N2H4(g)+O2(g)=N2(g)+2H2O(l)△H= —534.4kJ/mol
D. N2H4(g)+O2(g)=N2(g)+2H2O(g)△H= —534.4kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省洛阳市高二(平行班)3月月考化学试卷(解析版) 题型:选择题
下列有机物的命名中,正确的是( )
A. 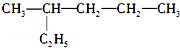 (2-乙基戊烷) B.
(2-乙基戊烷) B. 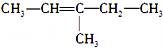 (3-甲基-2-戊烯)
(3-甲基-2-戊烯)
C. 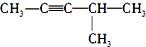 (2-甲基-戊炔) D.
(2-甲基-戊炔) D. 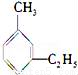 (1-甲基-5-乙基苯)
(1-甲基-5-乙基苯)
查看答案和解析>>
科目:高中化学 来源:2017届陕西省西安市高三模拟(一)理综化学试卷(解析版) 题型:实验题
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究。完成下列空格。
①提出假设:
假设1:只存在Fe2O3;假设2:_________;假设3:既存在Fe2O3也存在Cu2O。
②查找资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
③实验方案设计与分析:
方案一:步骤一:取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出假设____不成立,写出产生上述气体的化学方程式___________________。
步骤二:取少量步骤一溶液置于试管中滴加_______,振荡,若________,则说明假设3成立。
方案二:
取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设_不成立。
方案三:
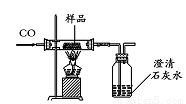
同学们设计了如下实验方案测定该样品中Fe2O3的质量分数(装置气密性良好,假设样品完全反应):
步骤一:取样品并称量该样品的质量为m1;
步骤二:测出反应前广口瓶和瓶内物质总质量m2;
步骤三:测出反应后广口瓶和瓶内物质总质量m3;
步骤四:计算得出矿物样品中Fe2O3的质量分数。
讨论分析:该实验方案________(填“能”或“不能”)测出矿物中Fe2O3的质量分数。不改变装置和药品,通过计算得出矿物中Fe2O3的质量分数,你还可以通过测定_______。若测得m1为3.04g,m3=m2+1.76g,则原样品中Fe2O3的质量分数为_____(结果保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市高二下学期学业水平测试(二)化学试卷(解析版) 题型:简答题
碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如下:
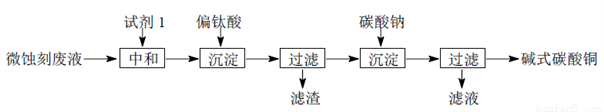
(1)试剂1最好选用________________。
a.Fe2O3 b.CaCO3 C.CuO
(2)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,写出该反应的化学方程式______________________。
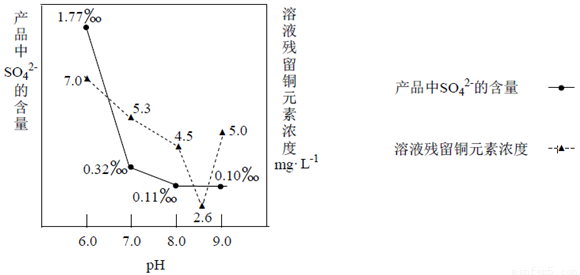
(3)加入Na2CO3沉淀时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在___________________________。
(4)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O,要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称取12.0克的样品;②高温分解;③测出生成CO2的质量为2.2克;④测出生成水蒸气的质量为1.8克;⑤称量生成CuO的质量为8.0克。而乙同学认为除步骤②外,实验只需测定四个量中的部分数据即可,则合理的组合为______________(填序号,写一组即可)。根据你的选择,计算出碱式碳酸铜的组成,写出计算过程。____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com