

 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$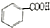
 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$ +H2O.
+H2O. (任写一种即可).对于化合物X,下列说法正确的是AC.
(任写一种即可).对于化合物X,下列说法正确的是AC. :则Z的同分异构体中,符合
:则Z的同分异构体中,符合 结构且有2个CH3的有3种(不包括Z).
结构且有2个CH3的有3种(不包括Z). 分析 丙烯与氯气发生取代反应得到A,A在碱性条件下水解得到D,D可以连续发生氧化反应,则A为CH2=CHCH2Cl,D为CH2=CHCH2OH,E为CH2=CHCHO,F为CH2=CHCOOH,A与氯气发生加成反应得到B为ClCH2CHClCH2Cl,B发生水解反应得到C为 ,2分子F与1分子C发生酯化反应得到X.丙烯与苯发生加成反应得到G为
,2分子F与1分子C发生酯化反应得到X.丙烯与苯发生加成反应得到G为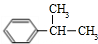 ,然后氧化得到苯甲酸.
,然后氧化得到苯甲酸.
解答 解:丙烯与氯气发生取代反应得到A,A在碱性条件下水解得到D,D可以连续发生氧化反应,则A为CH2=CHCH2Cl,D为CH2=CHCH2OH,E为CH2=CHCHO,F为CH2=CHCOOH,A与氯气发生加成反应得到B为ClCH2CHClCH2Cl,B发生水解反应得到C为 ,2分子F与1分子C发生酯化反应得到X.丙烯与苯发生加成反应得到G为
,2分子F与1分子C发生酯化反应得到X.丙烯与苯发生加成反应得到G为 ,然后氧化得到苯甲酸.
,然后氧化得到苯甲酸.
(1)F为CH2=CHCOOH,含氧官能团是羧基,故答案为:羧基;
(2)一定条件下Y+D能合成一种香料,该反应方程式为: +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为: +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$ +H2O;
+H2O;
(3)X的结构简式为 等,
等,
A.X、D均含有碳碳双键,二者可以发生聚合反应,故A正确;
B.X含有羟基,能与醋酸发生酯化反应,故B错误;
C.X含有碳碳双键,能使Br2/CCl4溶液褪色,故C正确;
D.X不含羟基,不能与新制氢氧化铜反应,故D错误,
故答案为: ;AC;
;AC;
(4)Z是G( )的同系物,其结构式为
)的同系物,其结构式为 ,则Z的同分异构体中,符合
,则Z的同分异构体中,符合 结构且有2个CH3,侧链有:-C(CH3)CH2CH2CH3、-CH2CH2CH(CH3)2、-CH(CH2CH3)2,共有3种,
结构且有2个CH3,侧链有:-C(CH3)CH2CH2CH3、-CH2CH2CH(CH3)2、-CH(CH2CH3)2,共有3种,
故答案为:3.
点评 本题考查有机物推断,根据有机物分子式与反应条件进行推断,需要学生熟练掌握官能团的性质与转化,较好的考查学生分析推理能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液中通入少量的二氧化硫:Ca2++3ClO-+SO2+H2O═CaSO4+2HClO+Cl- | |
| B. | 向偏铝酸钠溶液中通入少量的二氧化碳:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 向硅酸钠水溶液中通入少量的二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向次氯酸钠溶液中通入少量的二氧化碳:ClO-+CO2+H2O═HClO+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①② | C. | 只有②③ | D. | 只有①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
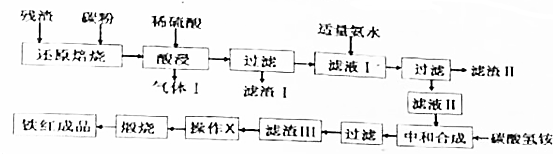
| 金属离子 | Fe3+ | Al3+ | Fe2+ |
| 开始沉淀的pH | 2.2 | 3.1 | 7.5 |
| 完全沉淀的pH | 3.5 | 5.4 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
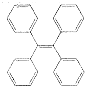 有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )
有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C26H22 | |
| B. | 该有机物属于苯的同系物 | |
| C. | 该有机物的一氯代物有4种 | |
| D. | 该有机物既可发生氧化反应,又可发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
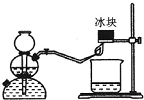 (1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.
(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移容易后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称氢氧化钠固体时直接放在称量纸上称 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com