
电化学是研究电和化学反应相互关系的科学.电池、电解都存在我们熟知的电化学反应.
(1)如图1是一种常见的一次锌锰酸性干电池.干电池工作时,负极上的电极反应式是: ,
MnO2的作用是除去正极上的气体产物,本身生成Mn2O3,该反应的化学方程式是: .
(2)以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出.
已知铜的化合物的颜色、性质如下:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液绿色,稀溶液蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
取电解CuCl2溶液后的阴极碳棒附着物,洗涤、干燥,连接如图2装置进行实验,验证阴极产物.
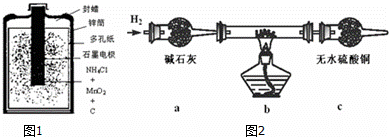
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
①碳棒上的红色物质有无Cu2O? (填“有”或“无”),请简要说明的理由: .
②在c装置后将气体通入硝酸银溶液中,出现白色沉淀,说明根据表中性质推测的阴极碳棒上的少量白色物质一定存在.试写出上述装置b中发生反应的化学方程式: .
③由以上实验分析可知:电解CuCl2溶液的阴极上发生的电极反应式为: .
| 原电池和电解池的工作原理.. | |
| 专题: | 电化学专题. |
| 分析: | (1)干电池工作时,负极上Zn失去电子,正极上生成氢气,则MnO2的作用是除去正极上的气体产物,本身生成Mn2O3,反应还生成水; (2)取电解CuCl2溶液后的阴极碳棒附着物,利用图2装置进行实验验证阴极产物,实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色,则红色物质为Cu,无水硫酸铜不变蓝,则没有水生成,即阴极碳棒附着物中不含氧元素,结合阴极铜离子得到电子及阳极氯离子失去电子来解答. |
| 解答: | 解:(1)干电池工作时,负极上Zn失去电子,电极反应为Zn﹣2e﹣═Zn2+;正极上生成氢气,则MnO2的作用是除去正极上的气体产物,本身生成Mn2O3,反应还生成水,该反应为2MnO2+H2═Mn2O3+H2O, 故答案为:Zn﹣2e﹣═Zn2+;2MnO2+H2═Mn2O3+H2O; (2)①因实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色,则阴极产物不含氧元素,由表格中物质的颜色可知,无Cu2O, 故答案为:无;无水硫酸铜不变色说明没有氧元素; ②c装置后将气体通入硝酸银溶液中,出现白色沉淀,则气体中含Cl元素,电解得到的阴极产物中白色物质为CuCl,装置b中发生反应的化学方程式为2CuCl+H2 ③由上述分析可知,电解CuCl2溶液时,阴极上发生的反应为铜失去电子生成铜离子(Cu2++2e﹣=Cu),且铜失去电子生成氯化亚铜:Cu﹣e﹣+Cl﹣=CuCl, 故答案为:Cu﹣e﹣+Cl﹣=CuCl. |
| 点评: | 本题考查原电池和电解池的工作原理,为高频考点,把握发生的电极反应为解答的关键,侧重分析与应用能力的考查,(2)中白色固体的推断为解答的难点,题目难度不大. |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的的是
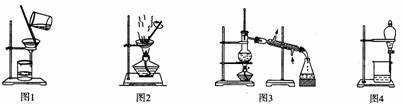
A.用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
B.用图2所示装置蒸发掉CuCl2溶液中部分水制得CuCl2·2H20晶体
C.用图3所示装置从CH3OH与C2H5OH的混合物中分离出乙醇
D.用图4所示装置从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
)短周期元素A、B,C、D的原子序数依次增大,它们的核电荷数之和为32,最外层电子数之和为10;A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,则下列叙述正确的是( )
|
| A. | D处于元素周期表第3周期ⅥA族 |
|
| B. | 四种元素原子的半径大小顺序是A<B<C<D |
|
| C. | B、D的最高价氧化物具有相似的物理性质和化学性质 |
|
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 化学键的断裂和形成是化学反应的实质,化学反应前后能量不变 |
|
| B. | 凡是放热反应都是自发的,吸热反应都是非自发的 |
|
| C. | 若一个反应的平衡常数越大,则表示该反应速率也越大 |
|
| D. | 升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应叙述相符合的是( )
|
| A. | 图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
|
| B. | 图Ⅱ:反应2SO2+O2═2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
|
| C. | 图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 |
|
| D. | 图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与日常生活密切相关,下列说法正确的是( )
A. 碘酒只是指碘单质的乙醇溶液
B. 纯水不易导电,但属于电解质
C. 质量分数:医用酒精>生理盐水>食醋
D. 明矾可用于水的消毒、杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是( )
|
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 |
|
| C. | 铝与Fe2O3发生铝热反应 | D. | 将锌粒投入Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,还含有CCl4、I2、I﹣)中回收碘,其实验过程如图1:
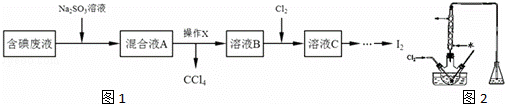
(1)向含碘废液中加入稍过量的Na2SO3溶液时发生的离子方程式为 ;该操作的目的是 .
(2)操作X应在 (填写仪器名称图2)中进行,简述得到溶液B的过程:将混合溶液静置后,
(3)在三颈瓶中将溶液B用盐酸调至pH约为2,缓慢通入Cl2,在40˚C左右反应(实验装置如右图所示).实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 (填溶质的化学式).
(4)某含碘废水(pH约为4)中一定存在I2,可能存在I﹣或IO3﹣.可以使用 (填溶质的化学式,下同)溶液检验可能存在的I﹣或 溶液检验可能存在的IO3﹣.在检验该含碘废水中是否含有I﹣或IO3﹣前必需要进行的操作是 (填序号).
a.取适量含碘废水用CCl4多次萃取、分液
b.用NaOH溶液将溶液调节到中性
c.向溶液中滴入少量淀粉溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.常温下,反应C(s)+CO2(g) 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
D.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com