
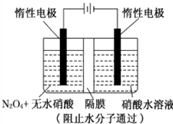
 如图所示装置可通过发生“3N2O4+8HNO3=6N2O5+2NO+4H2O”制备N2O5,有关说法中错误的是( )
如图所示装置可通过发生“3N2O4+8HNO3=6N2O5+2NO+4H2O”制备N2O5,有关说法中错误的是( )| A、阴极的电极反应为:NO3-+4H++3e-=NO↑+2H2O |
| B、阳极的电极反应为:N2O4+2 HNO3-2e-=2N2O5+2H+ |
| C、当电路中通过6 mol e-时整个电解池中参与反应的HNO3为8mol |
| D、当电路中通过6 mol e-时,有8molH+从阳极向阴极迁移 |


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| A、摩尔既是物质的数量单位又是物质的质量单位 |
| B、物质的量既表示物质的数量又表示物质的质量 |
| C、阿伏加德罗常数是12 kg 12C中含有的碳原子数目 |
| D、1 mol H2O中含有2 mol H原子和1mol O原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
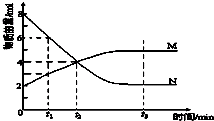 一定温度下在2L的密闭容器内进行反应,M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
一定温度下在2L的密闭容器内进行反应,M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )| A、反应的化学方程式:2M?N |
| B、t2时,正、逆反应速率相等,达到平衡 |
| C、平衡时,N的转化率为75% |
| D、若t1=2min,用N的浓度表示的化学反应速率为0.5 mol?(L?s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石英沙、水晶的主要成分都是SiO2 |
| B、SiO2是制光导纤维的主要原料 |
| C、石灰石是制普通玻璃、水泥的原料之一 |
| D、SiO2与水反应直接制得硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③④ |
| C、①④⑤ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HNO3、NO、H2O |
| B、N2、HNO3、H2O |
| C、N2、O2、H2O |
| D、N2O、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃烧反应都属于放热反应 |
| B、化学反应必然伴随着能量的变化 |
| C、吸热反应是指需要加热才能进行的反应 |
| D、化学键的断裂和形成是化学反应中能量变化的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅是制造光导纤维的材料,单质硅是良好的半导体材料 |
| B、SiO2和CO2都是酸性氧化物,但SiO2不能和水反应生成硅酸 |
| C、保存NaOH溶液时不能用玻璃塞 |
| D、二氧化硅性质稳定,不与任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B、熔融状态下能导电的化合物一定含离子键 |
| C、H2O2分子中所有的原子均为8电子稳定结构 |
| D、NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com