
【题目】下表为周期表前20号元素中某些元素的有关数据:
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
原子半径(10-10m) | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 |
最高价态 | +1 | +1 | —— | +1 | +4 | +5 | +7 | +1 | +5 |
最低价态 | —— | —— | -2 | -1 | -4 | -3 | -1 | —— | -3 |
试回答下列问题:(用对应具体符号或名称表示)
(1)以上9种元素的原子中,还原性最强的是________(名称),写出它的原子结构示意图:___________________ ;
(2)③与④可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:________________________________________(分解反应)。
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是_______________
(4)①、③、⑦三种元素形成的离子,其半径由小到大的顺序为_______________
(5)下列事实能说明元素⑦的非金属性比硫元素的非金属性强的是___________。
a.元素⑦形成的单质比硫元素形成的单质的熔点低
b.元素⑦和硫两元素的简单氢化物受热分解,前者的分解温度高
c.元素⑦的单质通入到H2S的溶液中出现浑浊
【答案】钾 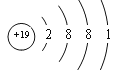 2H2O2
2H2O2 ![]() 2H2O + O2↑ 第三周期第VIA族 r(Na+)<r(O2-)<r(Cl-) bc
2H2O + O2↑ 第三周期第VIA族 r(Na+)<r(O2-)<r(Cl-) bc
【解析】
①、②、④、⑧最高价为+1,属于ⅠA族元素 ,根据原子半径可知①、②、④、⑧分别是Na、Li、H、K;③的化合价为-2,③是O元素;⑥、⑨最高价是+5、最低价为-3,根据原子半径可知⑥、⑨分别是P、N;⑤最高价是+4、最低价为-4,原子半径大于N,所以⑤是C元素;⑦最高价为+7、最低价为-1价,⑦是Cl元素。
(1)金属性越强,还原性越强,以上9种元素的原子中,还原性最强的的是钾;
钾原子核外有19个电子,原子结构示意图: ;
;
(2)O与H形成的10电子分子是H2O,18电子的分子是H2O2,H2O2可分解为H2O和氧气,化学方程式:2H2O2 ![]() 2H2O + O2↑。
2H2O + O2↑。
(3) R的原子半径为1.04×10-10m,介于P、Cl之间,所以R元素是S,S在周期表中的位置是第三周期第VIA族;
(4)电子层数越多半径越大,电子层数相同时,质子数越多半径越小,Na+、O2-、Cl-半径由小到大的顺序为r(Na+)<r(O2-)<r(Cl-);
(5) a.单质的熔点是物理性质,不能比较元素的非金属性,故不选a;
b.非金属性越强,气态氢化物越稳定,所以HCl的分解温度高于H2S,能证明非金属性Cl>S,故选b;
c. 非金属性越强,单质的氧化性越强,氯气通入到H2S的溶液中出现浑浊,说明氯气氧化性大于S,能证明非金属性Cl>S,故选c;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】钋是原子序数最大的氧族元素,下列有关钋及钋的化合物的推测错误的是( )
A.钋是第116号元素B.钋是能导电的固体
C.钋的氢化物很稳定D.钋可能有两种不同价态的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(气密性已检验)。4、5、6是蘸有相应溶液的白纸,U型管上方插入填充有1.淀粉碘化钾溶液;2.NaBr溶液的两团棉花,两头带有弹簧夹的玻璃管:

实验过程:
Ⅰ. 关闭弹簧夹b,打开仪器a,滴加浓盐酸。
Ⅱ. 当4、5、6白纸发生颜色变化后,打开弹簧夹b。
Ⅲ. 当玻璃管中蘸有NaBr溶液的棉花团变成红棕色后关闭弹簧夹b。
Ⅳ.……
(1)仪器a是_______________;
(2)U型管中产生黄绿色气体,其电子式是_______________。
(3)验证氯气的氧化性强于碘的实验现象是_______________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_______________。
(5)过程Ⅲ实验的目的是_______________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:(从原子结构的角度解释)_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )

A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于如图所示转化关系(X代表卤素)的说法错误的是

A. ΔH3<0
B. ΔH1=ΔH2+ΔH3
C. 按Cl、Br、I的顺序,ΔH2依次增大
D. ΔH1越小,HX越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A.1mol任何纯净物都含有相同的原子数
B.1mol O2中约含有6.02×1023个氧气分子
C.1mol氢中含有2mol氢原子
D.阿伏加德罗常数就是6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质物质的量都为1mol,完全燃烧生成二氧化碳和水所消耗相同条件下氧气的量最多的是
A. CH4B. CH3CHOC. C2H5OHD. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含BeO:25%、CuS:71%、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:I.铍、铝元素化学性质相似
II.常温下:Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=-2.1×10-13
(1)滤液A的主要成分除NaOH外,还有_____ (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式_____________。
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择最合理步骤顺序______。
a.加入过量的NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HC1 e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS 发生反应的化学方程式______________。
②若用浓HNO3溶解金属硫化物,缺点是____________(任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol/L、c(Fe3+)=0.008mol/L c(Mn2+)=0.01mol/L,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是![]() 和
和![]() ,电解质溶液为
,电解质溶液为![]() 溶液,电极反应为:
溶液,电极反应为:![]() ,
,![]() 。根据上述反应式,完成下列题目。
。根据上述反应式,完成下列题目。

①下列叙述正确的是_______。
![]() .在使用过程中,K+流向Zn极
.在使用过程中,K+流向Zn极
![]() .使用过程中,电子由
.使用过程中,电子由![]() 极经外电路流向
极经外电路流向![]() 极
极
![]() .
.![]() 是负极,
是负极,![]() 是正极
是正极
![]() .
.![]() 电极发生还原反应,
电极发生还原反应,![]() 电极发生氧化反应
电极发生氧化反应
②写出电池的总反应式:________________________________________________________________ 。
③使用时,电解质溶液的![]() ________。
________。
(2)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-2PbSO4+2H2O,请回答下列问题:①放电时,正极的电极反应式是 _____________________________________________________________________;
②电解液中![]() 的浓度将变_______;
的浓度将变_______;
③当外电路通过![]() 电子时,理论上负极板的质量增加_______
电子时,理论上负极板的质量增加_______![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com