
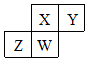 短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )| A. | 元素Y有同素异形体 | |
| B. | 最高价氧化物对应水化物的酸性:X>Z | |
| C. | 简单气态氢化物的热稳定性:Y>Z | |
| D. | 原于半径:W>Z>Y>X |
分析 由短周期元素X、Y、Z、W在元素周期表中的相对位置,可知W位于第三周期,W原子的质子数是其最外层电子数的三倍,设最外层电子数为x,则10+x=3x,解得x=5,可知W为P,结合元素的位置可知,Z为Si,X为N,Y为O,以此来解答.
解答 解:由上述分析可知,X为N,Y为O,Z为Si,W为P,
A.Y存在氧气、臭氧,互为同素异形体,故A正确;
B.非金属性N>Si,最高价氧化物对应水化物的酸性:X>Z,故B正确;
C.非金属性O>Si,简单气态氢化物的热稳定性:Y>Z,故C正确;
D.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原于半径:Z>W>X>Y,故D错误;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
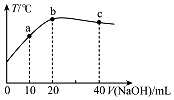 在一隔热系统中,向20.00mL 0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )| A. | 若a点溶液呈酸性,此时:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) | |
| B. | B.从a到b:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | 水的电离程度:b点<c点 | |
| D. | 溶液的pH值:a点<c点<b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ |
| PH | 11 | 3 | 3 |
| 溶液 | NaOH溶液 | CH3COOH溶液 | HF溶液 |
| A. | CH3COOH稀溶液中加入少量CH3COONa,能使比值c(CH3COO-)/c(Na+)增大 | |
| B. | ①、②等体积很合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 向②加入NaF固体,CH3COOH电离平衡正向移动 | |
| D. | 中和相同体积的②、③,需消耗①的体积②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作步骤 | 实验现象 | 结论 |
| 取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无SO2(或HSO3-或SO32-)生成 |
| 另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②白色沉淀 | 有SO42-生成 |
| ③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙内 加入足量稀硝酸酸化的硝酸银溶液 | 有白色沉淀生成 | 有Cl-生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| B. | 氯水中加入稀硫酸,可增强氯水的漂白性 | |
| C. | 用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气 | |
| D. | 加工后具有吸水性的植物纤维可用作食品干燥剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com