
| A. | AgCl>AgI>AgBr | B. | AgCl>AgBr>AgI | C. | AgBr>AgCl>AgI | D. | AgBr>AgI>AgCl |
分析 c(Ag+)=$\sqrt{Ksp}$,结合Ksp(AgCl)=1.8×10-10、Ksp(AgI)=1.5×10-16、Ksp(AgBr)=7.7×10-13计算.
解答 解:由Ksp(AgCl)=1.8×10-10、Ksp(AgI)=1.5×10-16、Ksp(AgBr)=7.7×10-13可知,c(Ag+)=$\sqrt{Ksp}$,Ksp(AgI)最小,则c(Ag+)最小,Ag+浓度大小顺序为AgCl>AgBr>AgI,
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握银离子浓度与Ksp的关系为解答的关键,侧重分析与计算能力的考查,注意Ksp的应用,题目难度不大.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
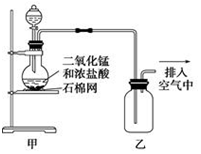
| A. | 该装置图中至少存在两处明显错误 | |
| B. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 | |
| C. | 烧瓶中的MnO2可换成KMnO4 | |
| D. | 在集气瓶的导管口处放一片湿润的淀粉--KI试纸可以证明是否有氯气逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
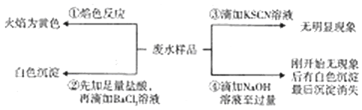
| A. | 废水含有Na+,不含K+ | B. | 废水含有SO42-和CO32- | ||
| C. | 废水不含Fe3+,可能含Fe2+ | D. | 废水一定含有Na+、Al3+、SO42-. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
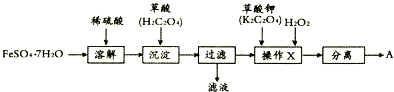
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学创新实验小组设计如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃.
某化学创新实验小组设计如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃.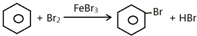 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知H2O(l)=H2O(g)△H=+44 kJ/mol,则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的热量 | |
| C. | 硝酸铵溶于水温度降低,这个过程发生的是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下△H的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.6 | B. | 0.9 | C. | 1.6 | D. | 1.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com