
【题目】下列物质之间的相互关系错误的是( )
A.CH3CH2OH和CH3OCH3互为同分异构体
B.干冰和冰为同一种物质
C.CH3CH3和CH3CH2CH3互为同系物
D.12C和14C互为同位素
科目:高中化学 来源: 题型:
【题目】(8分).氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是 。
A.制汽轮机叶片 | B.制有色玻璃 | C.制永久性模具 | D.制造柴油机 |
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,她不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式为 。
(3)现用四氯化硅和氮气在氢气中加强热发生反应,可制得高纯度氮化硅,反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在向盛有氯化铁溶液的烧杯中加入过量铜粉,反应结束后过滤,对溶液中大量存在的金属阳离子的成分判断正确的是
A.只有Cu2+B.Fe2+、Cu2+C.Fe3+、Fe2+D.Fe3+、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)烃A的分子式为_________。
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是_____;若总质量一定,充分燃烧消耗氧气的量不变的是____。
A. C7H8 B.C6H14 C.C7H14 D.C8H8
(3)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。
①A的结构简式为__________。
②链烃A与Br2的CCl4溶液反应生成B,写出由A生成B的化学方程式:_________
③与A互为同分异构体,且主链碳原子个数与A相同的链烃有_____种(不包括A)
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的所有碳原子是否在同一平面上__________。(是 否)
(5)如图:
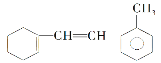
①该物质与足量氢气完全加成后环上一氯代物有________种;
②该物质和溴水混合,耗Br2的物质的量为_______mol;
③该物质和H2加成需H2________mol;判断下列说法不对的有________。
A.此物质可发生加成、取代、氧化等反应,不能发生加聚反应
B.和甲苯属于同系物
C.使溴褪色的原理与乙烯相同
D.能使酸性KMnO4溶液褪色是发生的加成反应
(6)按下列要求,回答问题:
如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
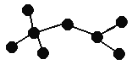
①用系统命名法命名________。
②M的二氯代物有________种。
③M是由某烯烃加成生成的产物,则该烯烃可能有_______种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。微粒物质的量的变化如图所示。下列说法正确的是
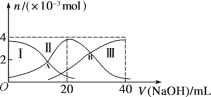
A. 当V(NaOH)=20 mL时,溶液中离子浓度关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B. 当V(NaOH)=30 mL时,则有:2c(H+) + c(HA-) +2c(H2A) =c(A2-) +2c(OH-)
C. 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH减小
D. 若A、B两点对应的溶液pH值分别为a、b,则H2A![]() 2H++A2-的K=10-a-b
2H++A2-的K=10-a-b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A. 混合气体的压强 B. 混合气体的密度 C. 体系的温度 D. 气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应(反应的装置如下图所示):
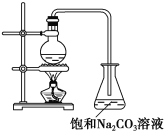
CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有____________、____________等。
(2)若用上图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为________、________等。
(3)若向反应液中加入H218O,则18O会在哪些物质中存在________。
(4)锥形瓶中的饱和Na2CO3溶液的作用是____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
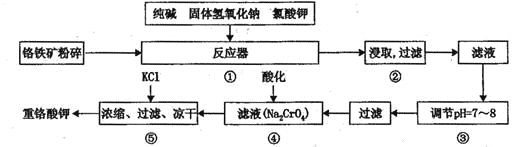
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:________________。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:_______________。
(3)简要叙述操作③的目的:________________________。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:___________。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度________________ (设整个过程中其它杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现以下各步转化,请写出括号内应加入的试剂。
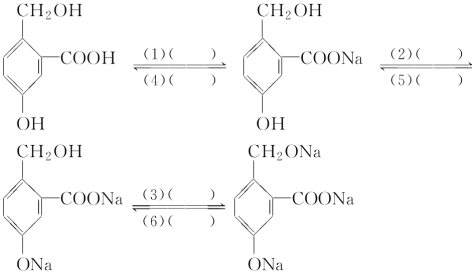
(1)________________;
(2)________________;
(3)________________;
(4)________________;
(5)________________;
(6)________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com