
【题目】常温下,Ksp(CaCO3)=2.8×10-9,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是

A.a点是CaSO4的饱和溶液而b点不是
B.蒸发水可使溶液由b点变化到a点
C.常温下,CaCO3(s)+![]() (aq)
(aq)![]() CaSO4(s)+
CaSO4(s)+![]() (aq)的K=3.1×10-4
(aq)的K=3.1×10-4
D.除去锅炉中的CaSO4时,可用Na2CO3溶液将其转化为CaCO3
【答案】B
【解析】
曲线上的点均为硫酸钙溶解平衡点,a点对应的溶液c(Ca2+)=3×10-3mol/L,c(SO42-)=3×10-3mol/L,所以Ksp(CaSO4)= c(Ca2+)·c(SO42-)=9×10-6。
A.a点位于溶解平衡曲线上,所以为饱和溶液,b点位于曲线下方,该点处溶液中c(Ca2+)·c(SO42-)<9×10-6,所以为非饱和溶液,故A正确;
B.b点和a点溶液中硫酸根浓度相同,蒸发水硫酸根和钙离子浓度均会增大,无法变化到a点,故B错误;
C.对于反应CaCO3(s)+SO42-(aq)![]() CaSO4(s)+CO32-(aq)平衡常数K=
CaSO4(s)+CO32-(aq)平衡常数K=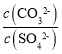 =
=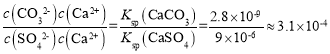 ,故C正确;
,故C正确;
D.常温下Ksp(CaSO4)> Ksp(CaCO3),二者为同类型沉淀,所以硫酸钙的溶解度大于碳酸钙的溶解度,所以Na2CO3溶液可将CaSO4转化为CaCO3,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】实验小组探究盐酸和NaOH反应过程中溶液pH的变化规律,得到如图所示曲线。下列有关该实验事实的说法正确的是( )
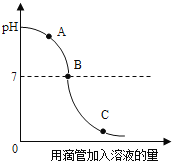
A.A点时溶液呈酸性
B.B点表示盐酸和NaOH恰好完全反应
C.C点时,溶液中的溶质只有氯化钠
D.该实验是将NaOH溶液滴入盐酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在同温同压下,同体积的气体甲烷(CH4)和二氧化碳密度之比为_________。
(2)在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1molL-1,SO42-的物质的量浓度为0.3molL-1,则混合液中K+的物质的量浓度为______________ molL-1 。
(3)将铝粉加入氢氧化钠溶液中,写出该反应的离子方程式:__________。
(4)用KMnO4氧化盐酸溶液,反应方程式如下2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,则反应中被氧化的HCl的物质的量是___ mol;用单线桥标出电子转移的方向和数目。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,1.7g氨气所占的体积为_______L,它与标准状况下______L硫化氢含有相同数目的氢原子。
(2)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_______,R的相对原子质量为_________。
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该混合气体中含CO___g,所含CO2在标准状况下的体积为_______L。
(4)同温同压下,SO2与Cl2的密度之比为______;若质量相同,两种气体的体积比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图____________________________
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示)。
(3)X元素的气态氢化物溶于水后与其最高价氧化物对应水化物反应的离子方程式为__________。
(4)元素Y和硫元素可形成化合物Y2S,请用电子式表示该化合物的形成过程________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是![]()
![]()
A. 1mol苯分子中含有C=C双键数目为3NA
B. 标准状况下,11.2LCCl4中含有的共价键数目为2NA
C. 1mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA
D. 常温常压下,17g羟基含有的电子总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在NaClO和NaCl的混合溶液中:Ag+、K+、NO3-、I-
B.![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.K+、Na+、Br-、SiO32-在溶液中能大量共存通入过量CO2后仍能大量共存
D.由水电离的c(H+)=1×10-13mol·L-1的溶液中K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:则下列说法正确的是
①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =-41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g) +1/2O2(g)=H2O(l):ΔH>-241.8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com