

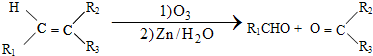
 $\stackrel{一定条件下}{→}$
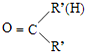
$\stackrel{一定条件下}{→}$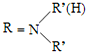 +H2O
+H2O +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O
 .(写出其中的一种的结构简式).
.(写出其中的一种的结构简式). $\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
$\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
 .
. 分析 A的分子式为C6H13Cl,为己烷的一氯代物,在氢氧化钠醇溶液、加热条件下发生消去反应得到B,1mol B发生信息①中氧化反应生成2mol C,且C不能发生银镜反应,B为对称结构烯烃,且不饱和C原子没有H原子,故B为(CH3)2C=C(CH3)2,C为(CH3)2C=O,逆推可知A为(CH3)2CH-CCl(CH3)2.D属于单取代芳烃,其相对分子质量为106,D含有一个苯环,侧链式量=106-77=29,故侧链为-CH2CH3,D为 ,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为
,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为 ,由F的分子式可知,E中硝基被还原为-NH2,则F为
,由F的分子式可知,E中硝基被还原为-NH2,则F为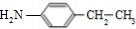 ,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为
,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为 ,据此分析解答.
,据此分析解答.
解答 解:A的分子式为C6H13Cl,为己烷的一氯代物,在氢氧化钠醇溶液、加热条件下发生消去反应得到B,1mol B发生信息①中氧化反应生成2mol C,且C不能发生银镜反应,B为对称结构烯烃,且不饱和C原子没有H原子,故B为(CH3)2C=C(CH3)2,C为(CH3)2C=O,逆推可知A为(CH3)2CH-CCl(CH3)2.D属于单取代芳烃,其相对分子质量为106,D含有一个苯环,侧链式量=106-77=29,故侧链为-CH2CH3,D为 ,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为
,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为 ,由F的分子式可知,E中硝基被还原为-NH2,则F为
,由F的分子式可知,E中硝基被还原为-NH2,则F为 ,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为
,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为 ,
,
(1)A发生消去反应生成B,反应方程式为C(CH3)2Cl-CH(CH3)2+NaOH$→_{△}^{乙醇}$C(CH3)2=C(CH3)2+NaCl+H2O,该反应为消去反应,
故答案为:C(CH3)2Cl-CH(CH3)2+NaOH$→_{△}^{乙醇}$C(CH3)2=C(CH3)2+NaCl+H2O;消去;
(2)D为 ,其名称是乙苯,D发生取代反应生成E,反应方程式为
,其名称是乙苯,D发生取代反应生成E,反应方程式为 +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$  +H2O,
+H2O,
故答案为:乙苯; +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$  +H2O;
+H2O;
(3)通过以上分析知,G结构简式为 ,
,
故答案为: ;
;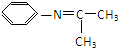
(4)F为 ,含有苯环同分异构体中,
,含有苯环同分异构体中,
若取代基为氨基、乙基,还有邻位、间位2种,
若只有一个取代基,可以为-CH(NH2)CH3、-CH2CH2NH2、-NH-CH2CH3、-CH2NHCH3、-N(CH3)2,有5种;
若取代为2个,还有-CH3、-CH2NH2或-CH3、-NHCH3,各有邻、间、对三种,共有6种;
若取代基有3个,即-CH3、-CH3、-NH2,2个甲基相邻,氨基有2种位置,2个甲基处于间位,氨基有3种位置,2个甲基处于对位,氨基有1种位置,共有2+3+1=6种,
故符合条件的同分异构体有:2+5+6+6=19,
其中核磁共振氢谱为4组峰,且面积比为6:2:2:1,说明含有2个-CH3,可以是 ,
,
故答案为:19; ;
;
(5)由苯与浓硝酸、浓硫酸在加热条件下得到H为硝基苯,硝基苯在Fe粉/盐酸条件下还有得到I为 ,再与(CH3)2C=O反应得到
,再与(CH3)2C=O反应得到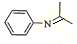 ,最后加成反应还原得到
,最后加成反应还原得到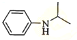 ,
,
故反应条件1所选用的试剂为:浓硝酸、浓硫酸,反应条件2所选用的试剂为:Fe粉/稀盐酸,I的结构简式为  ,
,
故答案为:浓硝酸、浓硫酸;Fe粉/盐酸; .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生获取信息并灵活运用信息解答问题能力,根据题给信息、反应条件、分子式进行推断,正确推断A、D结构简式是解本题关键,难点是(4)题同分异构体种类判断.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:解答题
 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  按系统命名法,如图有机物的命名为2,3-二甲基-3-乙基戊烷 按系统命名法,如图有机物的命名为2,3-二甲基-3-乙基戊烷 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单元链节是乙炔 | |
| C. | 总物质的量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 | |
| D. |  化学式为C10H14O,可以发生取代反应、聚合反应和氧化反应 化学式为C10H14O,可以发生取代反应、聚合反应和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Be原子的结构示意图: | |
| B. | 二氧化硅的分子式:SiO2 | |
| C. | 质子数为53、中子数为78的碘原子可表示为:53131I | |
| D. | 乙烯的结构式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
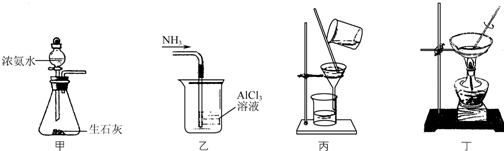
| A. | 用装置甲制取NH3 | |
| B. | 用装置乙吸收NH3制取Al(OH)3 | |
| C. | 用装置丙在不断搅拌下分离Al(OH)3和NH4Cl溶液 | |
| D. | 用装置丁蒸干NH4Cl溶液并灼烧制NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1CH3COOH与0.1 mol•L-1氨水等体积混合(pH=7): c(NH4+)=c(CH3COO-)=c(H+)=c(OH-) | |
| B. | 0.1 mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7): c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1CaCl2溶液等体积混合: c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合: c(HCO3-)>0.05 mol•L-1>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ( 2b+2c-a)kJ•mol-1 | B. | (a-2b-2c) kJ•mol-1 | ||
| C. | (b+c-a) kJ•mol-1 | D. | (a-2b-c) kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com