
【题目】已知A、B、C、D、E、F为元素周期表中前四周期且原子序数依次增大的六种元素.其中A、B、C、D核电荷数之和为36,A、C原子的最外层电子数之和等于B原子 的次外层电子数,D原子质子数为B原子质子数的两倍,E元素所在主族均为金属,F的价电子数与C的核电荷数相等。
(1)下列关于上述几种元素的说法正确的是_________。
a.B、C、D的原子半径由大到小的顺序为:D >C >B
b.E、F的最外层电子数相等
c.A、B、C、D四种元素中电负性和第一电离能最大的均为B
d.B与C形成的化合物中可能含有非极性键
e.A、C、F都位于周期表的3区
(2)B单质有两种同素异形体.其中在水中溶解度较大的是_______(填化学式)。
(3)EA2和A2B熔点较高的是 _______(填化学式),原因是_________。
(4)D与B可以形成两种分子,其中DB2分子中心原子的杂化类型是____。下列分子或离子中与DB3结构相似的是____________。
a. NH3 b. SO32- c.NO3- d.PCl3
(5)已知B、F能形成两种化合物,其晶胞如下图所示.则高温时甲易转化为乙的原因为 ___________。若乙晶体密度为pg/cm3,则乙晶胞的晶胞边长a =________nm(用含P和NA的式子表示)

【答案】 cd O3 CaH2 CaH2属于离子晶体,H2O属于分子晶体 sp2 c CuO中Cu2+外围电子排布为3d9,而Cu2O中Cu+外围电子排布为3d10,属于稳定结构 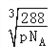 ×107 nm.
×107 nm.
【解析】A、B、C、D、E、F为元素周期表中前四周期且原子序数依次增大的六种元素,A、B、C、D核电荷数之和为36,则B不能位于第三周期,由于第三周期中Na、Mg、Al三者原子序数之和最小为36,A、C原子的最外层电子数之和等于B原子的次外层电子数,则B处于第二周期,A、C原子最外层电子数均为1,二者处于IA族,C、D不可能处于第三周期,因为第四周期中K、Ca二者原子序数之和最小为39,故C也属于短周期元素,C的原子序数又大于B,故C为Na,A为氢或锂,A、B、D原子序数之和为36-11=25,D原子质子数为B原子质子的两倍,则A为H元素、B为O元素、D为S元素;E元素所在主族均为金属,则E处于ⅡA族,原子序数大于硫,故E为Ca。F的价电子数与C的核电荷数相等,F的原子序数最大,因此F是Cu;
(1)a.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:C(Na)>D(S)>B(O),a错误;b.E为Ca、F为Cu,二者最外层电子数分别为2、1,b错误;c.H、O、Na、S四种元素中电负性和第一电离能最大的均为O,c正确;d.B与C形成的化合物为氧化钠、过氧化钠,过氧化钠中含有非极性键,d正确;e.H、Na位于周期表的s区,Cu处于周期表中ds区,e错误,答案选cd;(2)B单质有两种同素异形体有氧气、臭氧,O2分子为非极性分子,而O3分子为极性分子,水分子是极性分子,相似相溶,故在水中溶解度较大的是O3;(3)CaH2属于离子晶体,H2O属于分子晶体,熔点较高的是CaH2;(4)SO2分子中S原子孤电子对数=(62×2)/2=1,价层电子对数=2+1=3,故S原子的杂化类型是 sp2,SO3中S原子孤电子对数=(62×3)/2=0,价层电子对数为3+3=3,为平面三角形结构,NH3为三角锥形结构,SO32-中S原子孤电子对数=(6+22×3)/2=1,价层电子对数=3+1=4,为三角锥形结构,NO3- 中N原子孤电子对数=(5+12×3)/2=0,价层电子对数=3+0=3,为平面三角形结构,PCl3为三角锥形结构;(5)甲中Cu原子数目为4,氧原子数目为8×1/8+6×1/2=4,化学式为CuO,乙中Cu原子数目为4,氧原子数目为1+8×1/8=2,化学式为Cu2O,Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,属于稳定结构,故高温下CuO可以转化为Cu2O,乙晶体密度为pg/cm3,乙晶胞质量为2×144/NAg,则晶胞参数=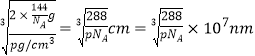 。
。


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.放热反应在任何温度下均能自发进行
B.自发过程指的是常温下,不借助外力就能自动进行的过程
C.熵增加的放热反应在任何温度下均能自发进行
D.对于同一物质,其混乱度大小为S(g)<S(l)<S(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:

已知:
RCOOR'+R'OH![]() RCOOR'+ R'OH(R、R'、R'代表烃基)
RCOOR'+ R'OH(R、R'、R'代表烃基)
(1)A属于芳香烃,其结构简式是______________________。B中所含的官能团是________________。
(2)C→D的反应类型是___________________。
(3)E属于脂类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:______________________________。
(4)已知:2E![]() F+C2H5OH。F所含官能团有
F+C2H5OH。F所含官能团有![]() 和___________。
和___________。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:

____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是调制草莓、葡萄屑桃,香子兰等香味的食用香精。在医药工业中作为有机合成的中问体。合成肉桂酸甲酯的工业流程如图所示:

已知:I.醛与醛能发生反应,原理如下:

Ⅱ.烃A在标准状况下的密度为1.25g/L。
请回答:
(1)化合物E的名称为_____________
(2)合成肉挂酸甲酯的工业流程中属于取代反应的有_______个,C中所含的官能团有 _______(写名称)。
(3)G→H的反应化学方程式为_____________。
(4)符合下列条件的的同分异构体共有_____________种。
A.能发生水解反应
B.与银氨溶液作用出现光亮的银镜
C.能与溴生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有3份等质量的小苏打,第1份直接与盐酸恰好完全反应;第2份首先加热,使其部分分解后,再与足量盐酸恰好完全反应;第3份首先加热,使其完全分解后,再与足量盐酸恰好完全反应。假若盐酸的物质的量浓度相同,消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是
A. V1>V2>V3 B. V1>V3>V2 C. V2>V3 >V1 D. V1=V2=V3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础。
(1)其中标示着使用温度的仪器是________。
(2)下列操作中,容量瓶所具备的功能有________ (填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的溶液 D.准确稀释某一浓度的溶液
E.量取一定体积的液体 F.用来加热溶解固体溶质
(3)如图是某些仪器的刻度部分示意图,图中各仪器虚线为所示读数。其中为量筒的是________(填编号)。读数为________mL。

(4)实验室用98%的浓硫酸配制(浓硫酸密度为1.84g/mL) 450mL 0.1mol/L的硫酸。回答下列问题。
①配制中应选用_______(写出规格) 的容量瓶应量取_____mL 98%的浓硫酸。
②量筒在使用前已洗干净但不干燥,对结果是否造成影响_______(填“是”或“否”),某同学认为将量筒内的浓硫酸倒出之后,应将量筒洗涤一下并将洗涤液并入烧杯中,最后转移到容量瓶中,你认为他的做法_______(填“对“或“错”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu→Cu2++2e-,还原反应式:2Fe3++2e-→2Fe2+.在稀硫酸中,KMnO4和H2O2能发生氧化还原反应5H2O2+2MnO+6H+===5O2↑+2Mn2++8H2O。
(1)将此氧化还原反应拆成半反应式,氧化式:_________,还原式:_________。
(2)反应中氧化剂是________;被氧化元素是__________;若有0.5 mol H2O2参加此反应,电子转移个数为____________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为________________________;这时若有0.5 mol H2O2发生分解,电子转移个数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:①甲烷、②乙烯、③乙醇、④乙酸。其中分子结构为正四面体的是______(填序号,下同);能使石蕊溶液变红的是______;能与溴的四氯化碳溶液发生加成反应的是______;能与金属钠反应产生氢气,且反应不如水与钠反应剧烈的是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com