
【题目】有机物M的结构简式为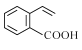 ,下列说法正确的是 ( )
,下列说法正确的是 ( )
A.有机物M既能使酸性KMnO4溶液褪色又能使溴水褪色,且反应类型相同
B.与有机物M具有相同的官能团,且不包括M的同分异构体有3种
C.1mol有机物M与足量氢气反应,消耗氢气4mol
D.有机物M能发生取代、加成、氧化、水解等反应
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是( )
A. 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B. 若将CO2通入0.1mol/LNa2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液:c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型药物克利贝特可由物质X在一定条件下制得,下列有关叙述正确的是
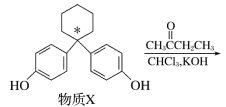
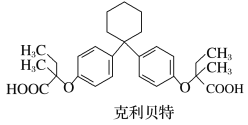
(注:化学上将连接四个不同基团的碳原子称为手性碳原子,可用*标记)
A.苯酚和物质X互为同系物
B.物质X中用*标记的碳原子为手性碳原子
C.1 mol 物质X最多可与8 mol H2发生加成反应
D.用饱和NaHCO3溶液可以鉴别物质X和克利贝特
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或试剂的选择都合理的是
A.减压过滤时,常用倾析法先转移上部清液,溶液量不超过漏斗容量的2/3,慢慢开大水龙头,待溶液快流尽时再转移下部沉淀
B.用酸性高锰酸钾溶液检验FeCl2和FeCl3混合液中的Fe2+
C.用NaOH溶液除去溶在乙酸乙酯中的乙酸
D.向CoCl2溶液中逐滴加入浓盐酸并振荡,溶液的颜色会从蓝色逐渐变成粉红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源。制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。
(1)已知; ![]() (g)+H2(g)→
(g)+H2(g)→![]() (g) H=-119.6kJ/mol
(g) H=-119.6kJ/mol
![]() (g)+2H2(g)→
(g)+2H2(g)→![]() (g) H=-237.1kJ/mol
(g) H=-237.1kJ/mol
![]() (g)+3H2(g)→
(g)+3H2(g)→![]() (g) H=-208.4kJ/mol
(g) H=-208.4kJ/mol
请求出![]() (g)+H2(g)→
(g)+H2(g)→![]() (g) H=________kJ/mol
(g) H=________kJ/mol
(2)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。
![]() (g)
(g)![]()
![]() (g)+3H2(g)
(g)+3H2(g)
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=_______(用含a、b的关系式表达)。
(3)一定条件下,如下图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成)。
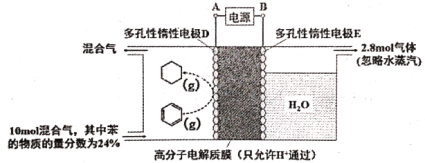
①实现有机物储氢的电极是__________;A 正极 B 负极 C 阴极 D 阳极
其电极反应方程为:___________。
②实验研究表明,当外加电压超过一定值以后,发现电极D产物中苯(g)的体积分数随着电压的增大而减小,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是__________。已知单质气体为2 mol,求此装置的电流效率η=__________。[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四期某些过渡元素在工业生产中有着极其重要的作用。
(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。
写出Cr在周期表中的位置___________;其原子核外电子排布的最高能层符号___________.
(2)在1 mol CrO5(其中Cr为+6价)中,含有过氧键的数目为___________。
(3)钒(23V)是我国的丰产元素,被称之为“工业的味精”,广泛用于催化及钢铁工业。回答下列问题:
写出钒原子价电子排布图___________;V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___________;

(4)Ni是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物Ni(CO)4,其中配原子是___________。
(5)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(CaTiO3)晶体是工业获取钛的重要原料。 CaTiO3晶胞如下图,边长为a=0.266m,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___________nm,与Ti紧邻的O个数为___________。

(6)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则T处于___________位置,O处于___________位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料。下列关于聚乙炔的叙述错误的是( )
A.聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B.聚乙炔的化学式为![]() 分子中所有碳原子不可能在同一直线上
分子中所有碳原子不可能在同一直线上
C.聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D.聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是
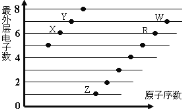
A.元素非金属性:X>R>W
B.X与R形成的分子内含两种作用力
C.X、Z形成的化合物中可能含有共价键
D.元素对应的离子半径:W>R>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为______(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为______(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO320克)配制稀硫酸,若用SO3nH2O表示20%的发烟硫酸,则n=______(保留两位小数)。
(3)某厂废水中含1.00×10﹣3mol/L的Cr2O72-,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2).欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4.理论上需要加入______g FeSO47H2O。
(4)硫酸亚铁铵[(NH4)2SO4FeSO46H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量.现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3﹣+3Cu2S+16H+→6Cu2++10NO↑+3SO42﹣+8H2O
8NO3﹣+3CuS+8H+→3Cu2++3 SO42﹣+8NO↑+4H2O
剩余的稀硝酸恰好与48mL 2mol/L (NH4)2Fe(SO4)2溶液完全反应.
已知:NO3﹣+3Fe2++4H+→NO↑+3Fe3++2H2O
试计算混合物中CuS的质量分数(保留两位小数)。______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com