
 锌及其化合物有着广泛的应用.请回答有关锌及其化合物的有关问题.
锌及其化合物有着广泛的应用.请回答有关锌及其化合物的有关问题.分析 (1)由题意书写反应物和生成物,标注化合价,判断氧化剂和还原剂,根据电子守恒配平化学方程式,依据配平的化学方程式计算电子转移总数;
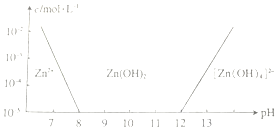
(2)根据图可知,当pH=8时,c(Zn2+)=10-5mol/L,根据Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)计算;
(3)浓硫酸吸收H2O、碱石灰吸收CO2,n(H2O)=$\frac{0.54g}{18g/mol}$=0.03mol、n(CO2)=$\frac{0.88g}{44g/mol}$=0.02mol,剩余固体为ZnO,n(ZnO)=$\frac{3.85g-0.54g-0.88g}{81g/mol}$=0.03mol,根据原子守恒计算判断其化学式.
解答 解:(1)高温锻烧时,闪锌矿(ZnS)与氧气反应生成ZnO和SO2,根据反应物和生成物和电子守恒书写配平化学方程式,ZnS~SO2~6e-;O2~4e-;最小公倍数为12,所以ZnS前的系数为2,氧气前的系数为3,观察配平化学方程式为2ZnS+3O2═2ZnO+2SO2;1mol还原剂ZnS转移电子为6mol;
故答案为:2ZnS+3O2═2ZnO+2SO2; 6;
(2)根据图可知,当pH=8时,c(Zn2+)=10-5mol/L,Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)=10-5×(10-6)2=1×10-17,故答案为:1×10-17;
(3)浓硫酸吸收H2O、碱石灰吸收CO2,n(H2O)=$\frac{0.54g}{18g/mol}$=0.03mol、n(CO2)=$\frac{0.88g}{44g/mol}$=0.02mol,剩余固体为ZnO,n(ZnO)=$\frac{3.85g-0.54g-0.88g}{81g/mol}$=0.03mol,根据原子守恒得(a+b):a:(b+c)=0.03mol:0.02mol:0.03mol=3:2:3,则a:b:c=2:1:2,所以沉淀的组成为2ZnCO3•Zn(OH)2•2H2O,
答:沉淀的组成为2ZnCO3•Zn(OH)2•2H2O.
点评 本题考查了氧化还原反应的电子转移,结合图象的分析锌离子在不同PH范围内的存在形式,难点是(3)题化学式的确定,利用原子守恒解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 将Al2O3固体粉末加到沸水中 | |
| B. | 将CO2气体不断通人到NaAlO2溶液中 | |
| C. | 将过量的金属钠投入到NaAlO2溶液中 | |
| D. | 向340ml 1mol/L NaOH溶液中加入80ml 1mol/L的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,S2和S8的固体混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 将1molFeCl3滴入足量沸水中,所分散系中粒子数目小于NA | |
| C. | 6.4g铜与硫反应时,铜失去的电子数为0.2NA | |
| D. | 标准状况下,44.8L NO与22.4L O2混合后气体中分子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼及其化合物在工农业生产中应用广泛.
硼及其化合物在工农业生产中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 144.0gCuSO4 | B. | 144.0gCuSO4•5H2O | ||
| C. | 255.0gCuSO4•5H2O | D. | 250.0gCuSO4•5H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com