
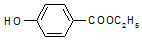
 ,生产过程如图:
,生产过程如图: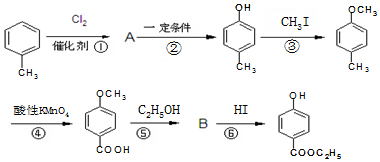
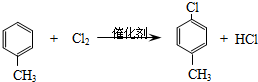 .
. ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是-OH、-CH2OH 或-OCH3.
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是-OH、-CH2OH 或-OCH3. 分析 甲苯和氯气发生取代反应生成A,A发生水解反应生成对甲基苯酚,根据对甲基苯酚结构简式知,甲苯中甲基对位上的氢原子苯氯原子取代,则A结构简式为 ;对甲基苯酚和碘烷发生取代反应生成对甲基苯甲醚,对甲基苯甲醚被酸性高锰酸钾溶液氧化生成对羧基苯甲醚,对羧基苯甲醚和乙醇发生酯化反应生成B,B结构简式为
;对甲基苯酚和碘烷发生取代反应生成对甲基苯甲醚,对甲基苯甲醚被酸性高锰酸钾溶液氧化生成对羧基苯甲醚,对羧基苯甲醚和乙醇发生酯化反应生成B,B结构简式为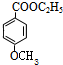 ,B发生取代反应生成对羟基苯甲酸乙酯,结合题目分析解答.
,B发生取代反应生成对羟基苯甲酸乙酯,结合题目分析解答.
解答 解:甲苯和氯气发生取代反应生成A,A发生水解反应生成对甲基苯酚,根据对甲基苯酚结构简式知,甲苯中甲基对位上的氢原子苯氯原子取代,则A结构简式为 ;对甲基苯酚和碘烷发生取代反应生成对甲基苯甲醚,对甲基苯甲醚被酸性高锰酸钾溶液氧化生成对羧基苯甲醚,对羧基苯甲醚和乙醇发生酯化反应生成B,B结构简式为
;对甲基苯酚和碘烷发生取代反应生成对甲基苯甲醚,对甲基苯甲醚被酸性高锰酸钾溶液氧化生成对羧基苯甲醚,对羧基苯甲醚和乙醇发生酯化反应生成B,B结构简式为 ,B发生取代反应生成对羟基苯甲酸乙酯,
,B发生取代反应生成对羟基苯甲酸乙酯,
(1)对羟基苯甲酸乙酯的结构简式为
故答案为,C9H10O3;2;
(2)A结构简式为 ,A中官能团是氯原子,反应④为氧化反应,
,A中官能团是氯原子,反应④为氧化反应,
故答案为:氯原子;氧化反应;
(3)反应①是甲苯与氯气在催化剂条件下发生甲基对位取代生成 ,同时还生成HCl,反应方程式为
,同时还生成HCl,反应方程式为 ,
,
故答案为: ;
;
(4)有机物C(分子构型为 ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,含有醛基,X为-OH时,Y为-CH2CH2CHO或-CH(CH3)CHO,X为-CH2OH或-OCH3时,Y为-CHO,即X为-OH、-CH2OH 或-OCH3,故答案为:-OH;-CH2OH 或-OCH3.
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,含有醛基,X为-OH时,Y为-CH2CH2CHO或-CH(CH3)CHO,X为-CH2OH或-OCH3时,Y为-CHO,即X为-OH、-CH2OH 或-OCH3,故答案为:-OH;-CH2OH 或-OCH3.
点评 本题考查有机物推断、官能团性质、有机反应类型、同分异构体等,注重学生对知识的强化训练,较好地考查学生对知识的迁移运用、分析推理等能力,明确官能团及其性质、物质之间的转化是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 弱酸 | HNO2 | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | Ki=5.1×10-4 | Ki=2.98×10-8 | $\begin{array}{l}{K_{i1}}=4.3×{10^{-7}}\\{K_{i2}}=5.6×{10^{-11}}\end{array}$ | $\begin{array}{l}{K_{i1}}=1.54×{10^{-2}}\\{K_{i2}}=1.02×{10^{-7}}\end{array}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Ⅰ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
Ⅰ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须大于水 | |
| B. | H2还原CuO时,先通H2后加热CuO,反应完毕后,先停止通H2后撤酒精灯 | |
| C. | 进行蒸馏操作时,冷凝管中的冷凝水应从下口进,上口出 | |
| D. | 当夜晚室内煤气泄漏时,先打开灯,再迅速开窗通气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com