

| 1��10-14 |
| 10-8 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | ���� | ԭ������ |
| A | �� H2O2�м���MnO2���ܼ���H2O2�ķֽ����� | MnO2�����˷�Ӧ����Ļ�� |
| B | ��5mL 0.005mol?L-1FeCl3��Һ�м���5mL 0.015mol?L-1KSCN��Һ����Һ�ʺ�ɫ���ٵμӼ���1mol?L-1KSCN��Һ����Һ��ɫ���� | ����Ӧ��Ũ�ȣ�ƽ��������Ӧ�����ƶ� |
| C | ��ʢ��NO2������ܱ�������������ˮ�У�������������ɫ���� | �÷�Ӧ��H��0��ƽ��������NO2�����ƶ� |
| D | ���ܱ��������з�Ӧ��A+xB��g��?2C��g�����ﵽƽ��ʱ���c��A��Ϊ0.5mol/L���������ݻ�����ԭ�������������c��A��Ϊ0.4mol/L-1 | A�����塢x=1 |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CH4--��Ȼ�� |
| B��CO2--ˮú�� |
| C��CaCO3--ʯ��� |
| D��NaHCO3--�մ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������� | B��������ϩ |
| C����ά�� | D��Ӳ֬������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | X | Y | Z |
| ��ʼŨ��/mol?L-1 | 0.1 | 0.2 | 0 |
| ƽ��Ũ��/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A��500 |
| B��600 |
| C��1 200 |
| D��1 600 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��H2O��HCOOH��Cu2��OH��2CO3��������Ԫ�أ����������� |
| B��HCOOH��H2CO3��H2SO4�����о�����������ԭ�ӣ����Ƕ�Ԫ�� |
| C��HF��CH3CH2OH��NaOH��������ˮ�����ǵ���� |
| D��HClO��H2SO4��Ũ����HNO3������ǿ�����ԣ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��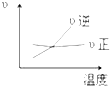 |
B��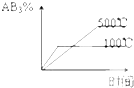 |
C��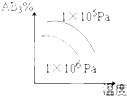 |
D�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 425 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
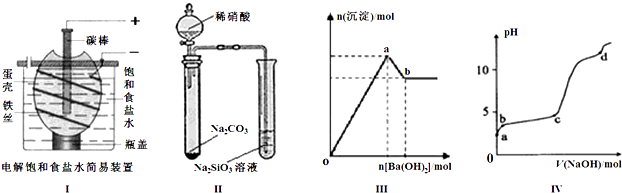
| A����ͼ��װ�õ��һ��ʱ�������������Һ�еμӼ��η�̪����Һ�ʺ�ɫ |
| B����ͼ��װ��ʵ�飬����֤������ǿ����ϵΪ�����̼����� |
| C��ͼ���ʾ����������Һ����μ���Ba��OH��2��Һ�����ɳ��������ʵ�����Ba��OH��2�������ı仯���ߣ���oa�η��������ӷ�ӦΪ�� 2Al3++3SO42-+3Ba2++6OH-=2Al��OH��3��+3BaSO4�� |
| D��ͼ����ʾ������ʱ����1mol?L-1 NaOH��Һ��ε���0.2mol?L-1 Al2��SO4��3��Һ�У�ʵ������ҺpH��NaOH��Һ����仯���ߣ���d��ʱAl��OH��3������ʼ�ܽ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com