
下列措施有利于反应N2(g) + 3H2 (g) 2NH3 (g) △H = -92kJ·mol-1平衡向正反应方向移动的是
①升高温度 ②降低温度 ③增大压强 ④减小压强
⑤增大NH3浓度 ⑥减小大NH3浓度
A.②④⑥ B.①③⑥ C.②③⑤ D.②③⑥
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| 容器编号 | n(O2) | n(NO) | n (NO2) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②v正____v逆 |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③v正____v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
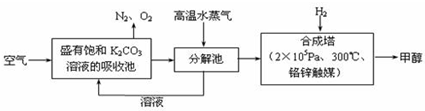
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度(K) CO2转化率(%) n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
| n(H2) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
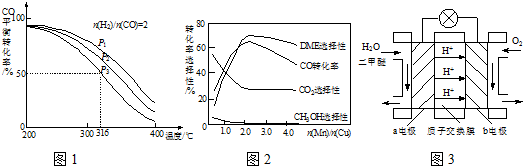
| n(H2) |
| n(CO) |
| n(H2) |
| n(CO) |
| n(Mn) |
| n(Cu) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com