
| A、氯气溶于水:Cl2+H2O?H++Cl-+HClO |
| B、铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ |
| C、少量的CO2通入氨水中:CO2+NH3?H2O=NH4++HCO3- |
| D、用醋酸溶液除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
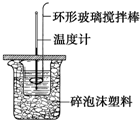 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COO-)<c(Na+) |
| B、c(CH3COOH)+c(CH3COO-)=0.02mol/L |
| C、c(CH3COOH)>c(CH3COO-) |
| D、c(OH-)+c(CH3COO-)═c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4++H2O?NH3?H2O+H+ |
| B、MgCl2+2H2O?Mg(OH)2+2HCl |
| C、HCO3-+H2O?CO32-+H3O+ |
| D、ClO-+H2O?HClO+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石跟稀盐酸反应:CO32-+2H+=CO2↑+H2 O |
| B、铁与硫酸铁溶液反应:Fe+Fe3+=2Fe2+ |
| C、A1C13溶液中加入足量的氨水:Al++3OH-=Al(OH)3↓ |
| D、铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是( )
将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是( )| A、A点pH小于7是因为Cu2+水解使溶液显酸性 |
| B、BC段阳极产物是Cl2 |
| C、整个过程中阳极先产生Cl2,后产生O2 |
| D、CD段电解的物质是水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与电源正极相连接的是电解槽的阳极 |
| B、与电源负极相连接的是电解槽的阴极 |
| C、电流从电源的负极沿导线流人电解槽的阴极 |
| D、在电解槽的阳极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com