
| A.一定等于0.1mol?L-1 | B.一定大于0.1mol?L-1 |
| C.一定小于0.1mol?L-1 | D.无法确定 |
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源:不详 题型:单选题
| A.Cl2的水溶液能导电,所以Cl2是电解质 |
| B.0.01 mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质 |
| C.在某温度下,测得纯水中c(H+)=2×10-7 mol/L,则c(OH-)为5×10-8mol/L |
| D.常温下0.1mol/L亚硝酸(HNO2)溶液的pH值为2.145,则亚硝酸是弱电解质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该溶液的pH=4 | B.升高温度,溶液的KW增大 |
| C.此酸的电离平衡常数约为1×10-7 | D.该溶液里不存在HA分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.同一弱电解质溶液,温度不同时,导电能力不同 |
| C.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
| D.强电解质在固态或液态时,可能不导电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
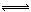 H+ + NO2-,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是 ( )
H+ + NO2-,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是 ( )| A.NaNO2溶液 | B.硫酸溶液 | C.NaOH溶液 | D.NaHSO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下物质的量浓度相等①NH4HSO4、②(NH4)2SO4、③(NH4)2CO3三种溶液中c(NH4+) ①<②<③ |
| B.在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.室温下,pH=3的盐酸和pH=11的氨水等体积混合后的溶液pH<7 |
| B.室温下,V1LpH=3的硫酸与V2LpH=11的NaOH溶液混合后,若混合溶液的pH=4,则V1:V2=11:9 |
| C.0.1mol·L-1醋酸的pH=a,0.01mol·L-1醋酸的pH= b,则a+1<b |
| D.在澄清石灰水中通入二氧化碳至过量,溶液的导电能力逐渐减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com